
【题目】固体A的化学式为![]() ,它的所有原子的最外层都符合相应稀有气体原子的电子层结构。其水溶液显碱性,则下列有关说法错误的是( )
,它的所有原子的最外层都符合相应稀有气体原子的电子层结构。其水溶液显碱性,则下列有关说法错误的是( )
A.![]() 中含有
中含有![]() 个N-H键
个N-H键
B.![]() 中既有共价键又有离子键,为离子化合物
中既有共价键又有离子键,为离子化合物
C.![]() 的电子式为
的电子式为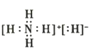
D.它与水反应的化学方程式为![]()
【答案】A
【解析】
固体A所有原子的最外层都符合相应稀有气体原子的电子层结构,可判断N与4个H分别共用一对电子形成NH4+,还有1个H有2个电子,以H-存在,所以,NH5由NH4+和H-构成。
A. 根据分析,1molNH5中含有1molNH4+和1molH-,N-H键数为4NA,A选项错误;
B. NH5中NH4+有N-H共价键,NH4+和H-之间有离子键,为离子化合物,B选项正确;
C. 根据分析可知,NH5由NH4+和H-构成,电子式为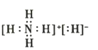 ,C选项正确;
,C选项正确;
D. NH5水溶液显碱性,说明生成了NH3H2O,则H-和+1价H生成H2,它与水反应的化学方程式为NH5 + H2O=NH3H2O + H2↑,D选项正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 均为短周期元素 , 它们在周期表中相对位置如图所示。若Z原子的最外层电子数是K层电子数的3倍, 下列说法中正确的是
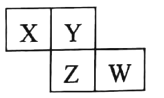
A.最高价氧化物对应水化物的酸性Z比W强
B.只由这四种元素不能组成有机化合物
C.与Z的单质相比较,Y的单质不易与氢气反应
D.X、Y形成的化合物都是无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.将1-氯丙烷与NaOH溶液共热几分钟后,冷却、加入过量稀硝酸酸化,滴加AgNO3溶液,得白色沉淀,证明其中含有氯元素
C.苯与浓溴水反应制取溴苯
D.![]() 溶液
溶液![]() 和
和![]() 溶液
溶液![]() 混合后加入
混合后加入![]() 的乙醛溶液
的乙醛溶液![]() ,加热煮沸观察沉淀的颜色
,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A在稀硫酸存在的条件下与水反应生成B、C两种物质,C经一系列氧化最终可转化为B的同类物质,等质量的B、C的蒸气在同温同压下所占体积相同,则A的结构共有( )
的有机物A在稀硫酸存在的条件下与水反应生成B、C两种物质,C经一系列氧化最终可转化为B的同类物质,等质量的B、C的蒸气在同温同压下所占体积相同,则A的结构共有( )
A.8种B.12种C.16种D.18种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
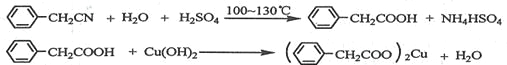
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
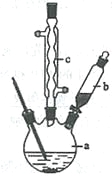
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
__________________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是_____________________;仪器c的名称是______________,其作用是___________________________________________。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是____________。下列仪器中可用于分离苯乙酸粗品的是________________(填标号)。
A.分液漏斗 | B.漏斗 | C.烧杯 | D.直形冷凝管E.玻璃棒 |
(3)提纯粗苯乙酸的方法是_____________,最终得到44 g纯品,则苯乙酸的产率是________。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是____________________________________________。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下所示。下列说法错误的是

A.甲位于现行元素周期表第四周期第ⅢA族
B.原子半径比较:甲>乙>Si
C.原子序数:甲-Ca=1
D.推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学上网查阅了如下资料:
中心原子杂化类型的判断方法:
(1)公式:n=(中心原子的价电子数+配位原子的成键电子数电荷数)/2
说明:配位原子为氧原子或硫原子时,成键电子数看为0;当电荷数为正值时,公式中取“-”号,当电荷数为负值时,公式中取“+”号。
(2)根据n值判断杂化类型:
当n=2时为![]() 杂化;n=3时为
杂化;n=3时为![]() 杂化;n=4时为
杂化;n=4时为![]() 杂化。
杂化。
请运用该方法计算下列微粒的![]() 值,并判断中心原子的杂化类型。
值,并判断中心原子的杂化类型。
(1)![]() :n= __________,__________杂化;
:n= __________,__________杂化;
(2)![]() :n= __________,__________杂化;
:n= __________,__________杂化;
(3)![]() :n= __________,__________杂化;
:n= __________,__________杂化;
(4)![]() :n= __________,__________杂化。
:n= __________,__________杂化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是 ( )
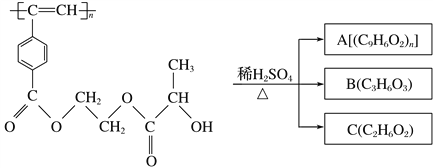
M
A. M与A均能使酸性高锰酸钾溶液和溴水褪色
B. B中含有羧基和羟基两种官能团,能发生消去反应和酯化反应
C. 1 mol M与热的烧碱溶液反应,可消耗2n mol NaOH
D. A、B、C各1 mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗替戈汀是一种用于治疗帕金森病的药物,其合成路线流程图如下:
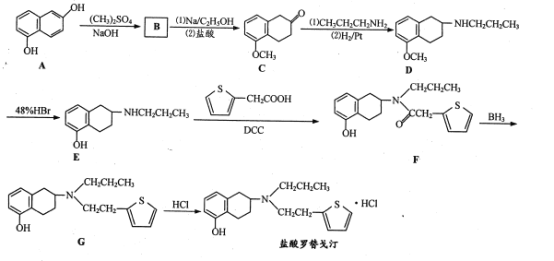
(1)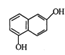 、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
(2)D→E的反应类型是_______。
(3)B的分子式为C12H12O2,写出B的结构简式;____ 。
(4)C的一种同分异构体X同时满足下列条件,写出X的结构简式:_______。
①含有苯环,能使溴水褪色;
②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
(5)已知:![]()
![]() R3COOH+
R3COOH+![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备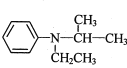 的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com