
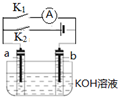
| A. | 断开K2,闭合K1一段时间,溶液的pH要变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为 2H++2e-═H2↑ | |
| C. | 断开K1,闭合K2时,OH-向b极移动 | |
| D. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O |
分析 A、断开K2,闭合K1时,不能构成原电池;
B、断开K1,闭合K2时,形成电解池,根据其工作原理来回答;
C、断开K1,闭合K2时,OH-向电解池的阳极移动;
D、断开K2,闭合K1时,不能形成原电池.
解答 解:A、断开K2,闭合K1时,不能构成原电池,溶液的pH不变,故A错误;
B、断开K1,闭合K2时,形成电解池,在碱性电解质下,b极是阴极,该电极上的电极反应式为 2H++2e-═H2↑,故B正确;
C、断开K2,闭合K1时,形成电解池,a极是阳极,OH-向a极移动,故C错误;
D、断开K2,闭合K1时,不能构成原电池,不会发生化学反应,故D错误;
故选B.
点评 本题考查学生原电池和电解池的工作原理,是一道物理电路和化学电池联系的一道综合题目,难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中肼作还原剂 | |
| B. | 液态肼的燃烧热△H为-641.6kJ•mol-1 | |
| C. | 该动力源的突出优点之一是生成物对环境污染小 | |
| D. | 肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片接电源的正极 | |
| B. | 铜片上发生的反应是:Ag++e-═Ag | |
| C. | 银片上发生的反应是:4OH--4e-═O2↑+2H2O | |
| D. | 需用硫酸铜溶液为电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②H2SO4(或HNO3、H2CO3) | ③NaOH(或KOH) ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO4 | ⑦CO2 ⑧Na2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com