
分析 (1)氯气和水反应生成具有杀菌作用的物质是次氯酸;
(2)与酸或强碱溶液生成盐和水的氧化物是两性氧化物;
(3)二氧化氮是红棕的气体;
(4)氨气与水反应生成一水合氨,一水合氨电离产生氢氧根离子;
(5)依据反应中浓硫酸中硫元素化合价变化解答;
(6)乙醇分子中含有的官能团为羟基;
(7)根据强酸制备弱酸的原理;
(8)根据在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯和水;
(9)苯性质较稳定,和酸性高锰酸钾溶液不反应,所以不能使酸性高锰酸钾溶液褪色.
解答 解:(1)自来水厂对水消毒,常使用的物质是液氯,故答案为:液氯;
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种两性氧化物,故答案为:两性;
(3)二氧化氮是红棕的气体,故答案为:红棕色;
(4)氨气与水反应生成一水合氨,一水合氨电离产生氢氧根离子,溶液显碱性,故答案为:碱;
(5)C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O在该反应中,浓硫酸中硫化合价全部降低,表现氧化性,故答案为:氧化;
(6)乙醇的结构简式为CH3CH2OH,其分子中含有的官能团为羟基或者-OH;
故答案为:羟基或者-OH;
(7)由2CH3COOH+CaCO3═(CH3COO)2Ca+CO2↑+H2O根据强酸制备弱酸的原理,可知酸性:醋酸>碳酸;
故答案为:>;
(8)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯和水,方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,故答案为:H2O;
(9)苯性质较稳定,和酸性高锰酸钾溶液不反应,所以不能使酸性高锰酸钾溶液褪色,故答案为:不褪色.
点评 本题考查了元素化合物知识和有机物的结构与性质,熟悉二氧化氮、氨气、浓硫酸性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | NO2 | C. | PM2.5 | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度比为1:1 | B. | 密度比为11:16 | C. | 体积比为16:11 | D. | 体积比为11:16 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入水中能得NH3•H2O | B. | 实验室用大理石与盐酸制取CO2 | ||
| C. | 久置的铁钉生锈 | D. | 蒸馏法将海水淡化为饮用水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | c(CO) | c(H2O)(g) | c(CO2) | c(H2) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
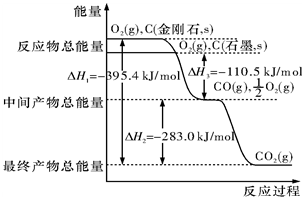 金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.
金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com