
【题目】反应2X(g)+Y(g)![]() 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
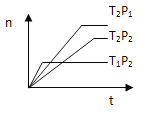
A. T1<T2,P1<P2 B. T1<T2,P1>P2
C. T1>T2,P1>P2 D. T1>T2,P1<P2
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层 电子数是次外层电子数的3倍,下列说法正确的是
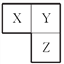
A. 在三种元素形成的简单气态氢化物中,Y的气态氢化物沸点最高
B. Z元素的氧化物对应的水化物一定是一种强酸
C. 三种元素原子半径的大小顺序为:X>Y>Z
D. Z的单质与Fe反应生成的化合物中,铁元素显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子
B. NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的
C. 对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高
D. 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A 元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填选项字母)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③![]() 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 cm。
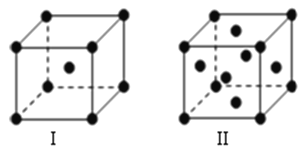
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸与金属反应,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。
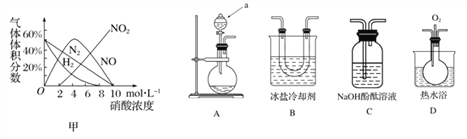
[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示
b.NO2沸点:21 ℃;NO沸点:-151 ℃
c.2NO2+2OH-===NO![]() +NO
+NO![]() +H2O,NO+NO2+2OH-===2NO
+H2O,NO+NO2+2OH-===2NO![]() +H2O
+H2O
(1)请写出Mg放入10 mol·L-1硝酸中反应的化学方程式:______________________;
[实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
(2)a仪器的名称是_____________。
(3)前一个C装置的作用是_______,证明气体产物中有NO生成的实验现象是______。
(4)从后一个C装置中逸出的气体是________。
(5)某同学测想A溶液中可能还有一种还原产物NH4NO3,请设计实验验证他的猜想_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是 ( )
A. PH3分子中有未成键的孤对电子 B. PH3是非极性分子
C. 它的分子构型是平面三角形 D. 磷原子采用sp2杂化方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子键、共价键、和分子间作用力是微粒之间的不同作用力。下列物质中只含有上述一种作用力的是
A. 冰 B. 碘单质 C. 氢氧化钠 D. 氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示各装置和实验室制取氧气的原理,回答下列问题:
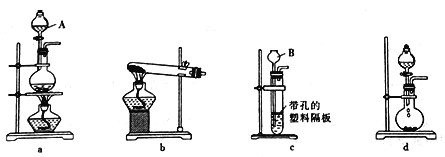
(1)仪器A、B的名称分别为_____、_________。
(2)用mgMnO2和n g KC1O3组成的固体混合物加热制取氧气时,可选用的实验装置是_____(填装罝序号)。
(3)将MnO2和KC1O3的混合物充分加热至不再产生氧气时,若要将其中的催化剂MnO2回收再利用,应进行的实验操作是将固体冷却、加水溶解、______、洗涤、干燥;洗涤MnO2固体的操作方法为_______________________。证明MnO2固体已洗涤干净的操作方法为____________________。
(4)将(2)中的固体混合物加热一段时间,冷却后称得剩余固体质量为p g,则当(m+n-p):n=___时,表明KC1O3已完全分解。
(5)用双氧水和MnO2制取氧气时,不能选用装置c,其原因是________________。
(6)用装置d制取氨气时,所需的化学药品是 ________________,氨气的电子式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.对于有气体参加的反应增大压强能提高活化分子的浓度
B.升高温度增大了活化分子百分数
C.催化剂能够改变化学反应途径
D.具有较高能量的反应物分子一定能发生有效碰撞
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com