
分析 (1)Cu与稀硝酸反应生成硝酸铜、NO和水;
(2)混合酸中硝酸的物质的量为:n(HNO3)=0.1L×0.5mol/L=0.05mol,硫酸的物质的量为:n(H2SO4)=0.1L×0.15moL/L=0.015moL,
溶液中所含氢离子的物质的量为:n(H+)=0.05moL+2×0.015moL=0.08mol,铜的物质的量为:n=$\frac{5.76g}{64g/mol}$=0.09mol,依据离子方程式:3Cu+2NO3-+8H+=3Cu2++2NO+4H2O计算解答.
解答 解:(1)Cu与稀硝酸反应生成硝酸铜、NO和水,其反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
答:反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)混合酸中硝酸的物质的量为:n(HNO3)=0.1L×0.5mol/L=0.05mol,硫酸的物质的量为:n(H2SO4)=0.1L×0.15moL/L=0.015moL,
溶液中所含氢离子的物质的量为:n(H+)=0.05moL+2×0.015moL=0.08mol,铜的物质的量为:n=$\frac{5.76g}{64g/mol}$=0.09mol,
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
3 2 8
0.03mol 0.02mol 0.08mol
由上述计算可知,H+不足,应该根据H+计算,由方程式可知n(Cu2+)=$\frac{3}{8}$n(H+)=$\frac{3}{8}$×0.08mol=0.03mol,
所以C(Cu2+)=$\frac{0.03mol}{0.1L}$=0.3 mol/L,
答:溶液中Cu2+的物质的量浓度为:0.3 mol/L.
点评 本题考查了硝酸的有关计算,明确利用离子反应方程式计算是解题的关键,题目难度不大,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
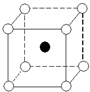 如图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子.已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g/mol,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞结构示意图(晶胞是指晶体中最小的重复单元),其中黑球表示氯离子、白球表示铯离子.已知晶体中2个最近的铯离子的核间距离为a cm,氯化铯的摩尔质量为M g/mol,则氯化铯晶体的密度为( )| A. | $\frac{2M}{{N}_{A}{a}^{3}}$g/cm3 | B. | $\frac{M}{2{N}_{A}{a}^{3}}$g/cm3 | C. | $\frac{M}{{N}_{A}{a}^{3}}$g/cm3 | D. | $\frac{M{a}^{3}}{{N}_{A}}$g/cm3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.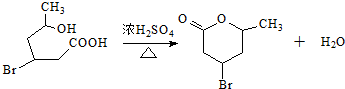 .
. (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为HCHO、CH3COCHO,它们物质的量之比是2:1.
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为HCHO、CH3COCHO,它们物质的量之比是2:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PX 项目的主要产品对二甲苯属于饱和烃 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com