
【题目】(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为:_____,若是改加氢氧化钡溶液至中性,离子反应方程式为:______。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2.25L 等浓度的Ba(OH)2溶液,离子反应方程式为:__。
(3)向含FeI2和FeBr2各1mol 的混合液中通入氯气2.5 mol,离子反应方程式为:____。
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为___。
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为____。
(6) Fe的一种含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是______。
【答案】H++HSO3-=H2O+SO2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O 2NH4++9OH-+2Al3++4SO42-+4Ba2+=4BaSO4↓+2NH3·H2O+Al(OH)3↓+AlO2-+2H2O 4I-+4Fe2++2Br-+5Cl2=2I2+4Fe3++Br2+10Cl- 2 NO3-+5H2 ![]() N2+2OH-+4H2O H2SO3+I2+H2O=4H++SO42-+2I- 4FeO42-+20H+ =4Fe3++3O2↑+10H2O
N2+2OH-+4H2O H2SO3+I2+H2O=4H++SO42-+2I- 4FeO42-+20H+ =4Fe3++3O2↑+10H2O
【解析】
(1)向NaHSO4溶液中滴加NaHSO3溶液生成SO2气体;若是改加氢氧化钡溶液至中性,氢离子与氢氧根离子恰好完全反应。
(2)1L 1mol/L的NH4Al(SO4)2溶液中含有1molNH4+、1molAl3+和2molSO42-,滴加2.25L 等浓度的Ba(OH)2溶液,即向溶液中加入2.25molBa2+和4.5molOH-,其中4.5molOH-先生成1molAl(OH)3、1mol/LNH3·H2O、并继续溶解0.5molAl(OH)3生成0.5molAlO2-;
(3)由2Fe3++2I-=2Fe2++I2;2Fe2++Br2=2Br-+2Fe3+可知,还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气先和碘离子反应,然后再和亚铁离子反应,最后再和溴离子反应;
(4)根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,据此书写方程式;
(5)碘单质将亚硫酸氧化成硫酸,据此写出反应的离子方程式;
(6) FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,说明有Fe3+生成,并有无色气体产生,根据电子转移守恒,只能为O元素被氧化,故还生成O2,配平书写离子方程式。
(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为H++HSO3-=H2O+SO2↑;将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O;
(2)1L 1mol/L的NH4Al(SO4)2溶液中含有1molNH4+、1molAl3+和2molSO42-,滴加2.25L 等浓度的Ba(OH)2溶液,即向溶液中加入2.25molBa2+和4.5molOH-,其中4.5molOH-先生成1molAl(OH)3、1mol/LNH3·H2O、并继续溶解0.5molAl(OH)3生成0.5molAlO2-,则发生反应的离子反应方程式为2NH4++9OH-+2Al3++4SO42-+4Ba2+=4BaSO4↓+2NH3·H2O+Al(OH)3↓+AlO2-+2H2O;
(3)含FeI2和FeBr2各1mol 的混合液中含有2molI-、2molFe2+,2molBr-,通入2.5molCl2,应依次氧化2molI-、2molFe2+和1molBr-,则发生反应的离子方程式为4I-+4Fe2++2Br-+5Cl2=2I2+4Fe3++Br2+10Cl-;
(4)根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,发生的反应为:2NO3-+5H2![]() N2+2OH-+4H2O;
N2+2OH-+4H2O;
(5)碘单质与亚硫酸发生氧化还原反应,反应的离子方程式为:H2SO3+I2+H2O=4H++SO42-+2I-;
(6) FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,说明有Fe3+生成,并有无色气体产生,根据电子转移守恒,只能为/span>O元素被氧化,故还生成O2,反应离子方程式为:4FeO42-+20H+=4Fe3++3O2↑+10H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质互为同系物的是
①乙二醇和丙三醇
②HCOOH与CH2=CH-COOH
③CH4与C3H8
④![]() CH3与
CH3与![]()
⑤CH![]() CH与CH2=CH-CH=CH2 ⑥1-丁烯与2-甲基丙烯
CH与CH2=CH-CH=CH2 ⑥1-丁烯与2-甲基丙烯
A. ①④⑤ B. ①④⑥ C. ③ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是最重要的氮肥,是产量最大的化工品之一。其合成原理为:N2(g)+3H2(g)![]() 2NH3(g), 某同学为了探究氮气和氢气反应生成氨气,在一恒温、恒容密闭容器中充入1 mol N2和3 mol H2混合发生下列反应,其中断裂1mol H2需要吸收436 kJ的能量,断裂1 mol N2需要吸收945 kJ的能量,断裂1 mol N-H键吸收391 kJ的能量。
2NH3(g), 某同学为了探究氮气和氢气反应生成氨气,在一恒温、恒容密闭容器中充入1 mol N2和3 mol H2混合发生下列反应,其中断裂1mol H2需要吸收436 kJ的能量,断裂1 mol N2需要吸收945 kJ的能量,断裂1 mol N-H键吸收391 kJ的能量。
(1)写出NH3的电子式___________________。
(2)该反应________(填“吸收”或“放出”)热量______________。
(3)当反应达到平衡时,N2和H2的转化率之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能光电池由于具有充电快、寿命长等特点,适于很多特殊环境和场合,现已得到广泛应用。氮化稼(GaN)光电池的结构如图所示。下列说法中正确的是( )

A. 该装置系统中只存在两种能量转化
B. Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O
C. 离子交换膜为质子交换膜,H+从右池移向左池
D. 常温下,当装置中有lmolCH4生成时,GaN电极有44.8LO2生成(不考虑O2的溶解性〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
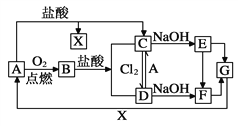
(1)写出A、C、F、G的化学式:A________,C_________,F_________,G_________。
(2)检验D中阳离子的方法_____________________________________________。
(3)保存C溶液时为什么要加固体A_____________________________________。
(4)写出下列转化的离子方程式C→D:____________________________________,由E转化为F的现象是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是

A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的c(H+)约为0.1molL-1
B.电池工作时,盐桥中的K+移向甲烧杯
C.电池工作时,外电路的电子方向是从a到b
D.乙池中的氧化产物为SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是

A. 图①:当CH4与Cl2体积比为1:2,维持足够长反应时间,CH4可全部变成CCl4
B. 图②:碎瓷片的作用与蒸馏实验中的碎瓷片作用不同
C. 图③:烷烃、烯烃、炔烃的单一物质及同类混合物含碳量随C原子数的变化曲线分别为a、b、c
D. 图④:点a代表的物质是PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
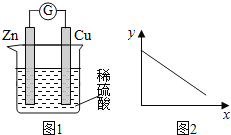
A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com