
| A、由水电离的c(H+):①=②>③=④ |
| B、将①、③两种溶液等体积混合后,pH可能不等于7 |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>② |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室常用下面装置制备乙稀,请回答下列问题:
实验室常用下面装置制备乙稀,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
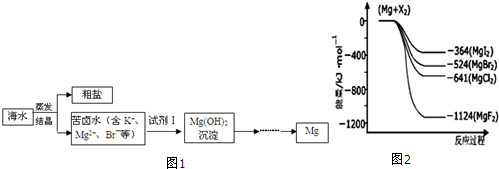
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上合成合成氨的热化学方程式如下:
工业上合成合成氨的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+ |
| B、一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+ |
| C、c (Clˉ) 为 4.00 mol?L-1,c (Al3+) 为1.00 mol?L-1 |
| D、c (Mg2+) 为 1.00 mol?L-1,c(Na+ ) 为 0.50 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
| A、最终可生成0.2mol NH3 |
| B、使用催化剂不影响反应速率 |
| C、升高温度反应速率增大 |
| D、增大压强反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com