
【题目】磷及含磷化合物是重要的化工原料,广泛应用于洗涤剂、农药、医药、水处理等行业回答下列问题:
(1)基态P原子的轨道表示式为 ___(填字母)。
a.[Ne]![]() b.[Ne]
b.[Ne]![]()
c.[Ne]![]() d.[Ne]
d.[Ne]![]()
(2)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:
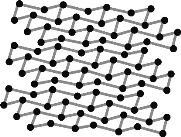
其中最小的环为___元环,每个环平均含有___个P原子。
(3)杀虫剂敌敌畏是有机磷化合物,其结构简式如图所示,其中C原子的杂化方式为____,甲基得一个电子后为CH3-,其空间构型为_____。
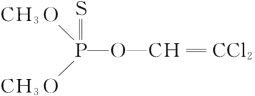
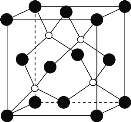
(4)磷化硼(BP)是一种超硬耐磨涂层材料,晶体中磷原子作面心立方最密堆积,硼原子填入四面体空隙中。
①PH3、NH3、BP三种物质的熔沸点由大到小的顺序为_____。
②磷化硼晶胞结构如图所示,晶胞参数a=b=c=478pm,α=β=γ=90°,则磷化硼的密度是___g·cm-3。(列出计算表达式,设阿伏加德罗常数为NA)
【答案】a 六 2 sp3、sp2 三角锥形 BP>NH3>PH3 ![]()
【解析】
(1)基态P原子的核外电子排布式为1s22s22p63s23p3或[Ne] 3s23p3,
则轨道表示式为 [Ne]![]()
答案选a;
(2)根据题干图示,黑磷晶体结构片段,最小的环为六元环,每个环含有六个P,每个P被三个环共用,每个环只占有一个P原子的三分之一,因此每个环平均含有2个P原子。
答案为:六;2;
(3)在有机化合物中,以全部为单键链接的碳是sp3杂化,双键连接的碳为sp2杂化,其结构简式如图所示,由全部单键的其中C(甲基),还含有碳碳双键,因此碳原子的杂化方式为sp3、sp2;甲基得一个电子后为CH3-,中心原子为碳,其价电子对数=3+![]() =4,该离子由四个原子组成,空间构型为三角锥形;
=4,该离子由四个原子组成,空间构型为三角锥形;
答案为:sp3、sp2 ;三角锥形
(4)①磷化硼(BP)是一种超硬耐磨涂层材料,熔沸点最高,NH3中含有氢键,三种物质的熔沸点由大到小的顺序为BP> NH3> PH3。
②磷原子半径大,硼原子半径小,因此大黑球为磷原子,小白球为硼原子。晶胞中磷原子的个数=![]() ,硼原子的个数=4;晶胞参数a=b=c=478pm,α=β=γ=90°,该晶胞为立方体,晶胞密度ρ=
,硼原子的个数=4;晶胞参数a=b=c=478pm,α=β=γ=90°,该晶胞为立方体,晶胞密度ρ=![]() =
=![]() =
=![]() ;
;
答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】双酚A( )是一种重要的化工原料,它的一种合成路线如下图所示:
)是一种重要的化工原料,它的一种合成路线如下图所示:
丙烯![]()
![]()
![]()
![]()
![]()
![]()
![]() 双酚A
双酚A
下列说法正确的是( )
A. 1 mol 双酚A最多可与2 mol Br2反应
B. G物质是乙醛的同系物
C. E物质的名称是1-溴丙烷
D. 反应③的化学方程式是![]() +O2
+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
E | L层上有2对成对电子 |
请根据表中信息填空:
(1)A原子的核外电子排布式为___________。
(2)B元素在周期表中的位置:__________________;离子半径:B___ A(填“大于”或“小于”)
(3)C原子的价电子排布图是___________,其原子核外有__________个未成对电子,能量最高的电子为___________轨道上的电子,其轨道呈___________形。
(4)D原子的电子排布式为___________。D-的结构示意图是________________
(5)C、E元素的第一电离能的大小关系是___________(用元素符号表示)。
(6)已知CD3分子中D元素为+1价,则C、D的电负性大小关系是________________(用元素符号表示),CD3与水反应后的产物是__________和__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。

(1)碘水吸收二氧化硫的离子方程式为___。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:___。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量___(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如图流程图所示:
![]()
(4)写出步骤①中反应的化学方程式___。
(5)写出步骤②中反应的离子方程式___。
(6)该尾气中二氧化硫的体积分数为___(气体体积已换算成标准状况,用含有V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,装置(I)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。下列说法正确的是

A. 闭合开关K时,电极B为负极,且电极反应式为:2Brˉ-2eˉ=Br2
B. 装置(I)放电时,总反应为:2Na2S2+Br2=Na2S4+2NaBr
C. 装置(I)充电时,Na+从左到右通过阳离子交换膜
D. 该装置电路中有0.1moleˉ通过时,电极Ⅹ上析出3.2gCu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、Cl2反应合成氯化亚砜。发生如下反应:
①Cl2(g)+SO2(g)![]() SO2Cl2(g) △H =-471.7kJmol-1
SO2Cl2(g) △H =-471.7kJmol-1
②SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g) △H=-5.6kJmol-1
2SOCl2(g) △H=-5.6kJmol-1
567K时,在10L密闭容器中,充入一定量的Cl2、SO2和SCl2,测得初始压强为P0反应过程中容器内总压强(P)随时间(t)变化(反应达到平衡时的温度与起始温度相同)如图所示,起始各组分及达平衡时SO2Cl2(g)的物质的量如表。

各组分 | Cl2 | SO2(g) | SCl2(g) | SO2Cl2(g) | SOCl2(g) |
起始/mol | 0.5 | 0.5 | 0.5 | 0 | 0 |
平衡/mol | 0.2 |
(1)图中数据显示0~l min体系压强增大的原因是____。
(2)反应①、②达到平衡时,SCl2的转化率为__。
(3)pK=-lgK,567K时,上述反应②的pK=___(结果保留两位有效数字,已知lg2=0.30)。
(4)567K下,若压缩容器体积为5L,则平衡时c(SO2)__(填“大于” “小于”或“等于”)上述反应平衡时的c(SO2)。
II.氯化亚砜常用于合成正丁酰氯。向连有尾气吸收装置的容器中按照物质的量1:1.5投料比加入正丁酸和氯化亚砜,反应为CH3CH2CH2COOH+SOCl2![]() CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
CH3CH2CH2COCl+SO2↑+HCl↑。实验测得温度和时间对反应的影响如表:
序号 | 实验方法 | 收率/% |
1 | 25℃,反应6h | 73.60 |
2 | 25℃,反应8h | 74.60 |
3 | 75℃,反应2h | 75.00 |
4 | 75℃,反应3h | 76.00 |
5 | 先25℃,反应1h;后75℃,反应0~1h | 81.10 |
6 | 先25℃,反应1h;后75℃,反应0~1h | 87.10 |
(5)若开始在较高温度下反应,则会放出大量气体。通过分析上表数据,选择合理实验方法的序号为___。说明你选用实验方法的理由:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )
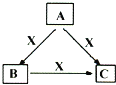
A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,H2R及其钠盐的溶液中,H2R、HR-、R2-分别在三者中所占的物质的量分数(α)随溶液pH变化关系如下图所示,下列叙述错误的是
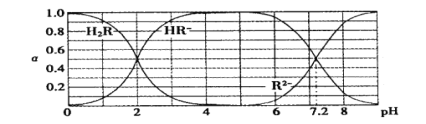
A.H2R是二元弱酸,其Ka1=1×10-2
B.当溶液恰好呈中性时,c( Na + )=2c ( R2- ) + c( HR- )
C.NaHR在溶液中水解倾向大于电离倾向
D.含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是

A. 将生成的气体直接通入到溴水中,溴水褪色,说明有乙炔生成
B. 酸性KMnO4溶液褪色,说明乙炔具有还原性
C. 逐滴加入饱和食盐水可控制生成乙炔的速率
D. 将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com