
| A、②③①④ | B、④①③② |
| C、③②①④ | D、③②④① |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
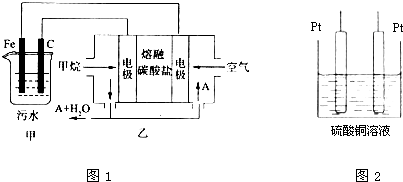
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2B溶液存在:c (Na+)=2c (HB-)+2c(B2-)+2c(H2B) |
| B、NaHB溶液一定显酸性 |
| C、HB-的水解方程式:HB-+H2O?H2B+OH- |
| D、NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+=H2B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| HNO2 | 4.6×10-4 | HClO | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、②③ | C、③⑥ | D、③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁硫醇与甲硫醇及乙硫醇互为同系物 |
| B、沸点不同的丁硫醇有四种 |
| C、甲硫醇分子中含有四个共价键 |
| D、丁硫醇在空气中完全燃烧生成三氧化硫、二氧化碳和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通甲烷的一极为负极,通氧气的一极为正极 |
| B、放电时通入氧气的一极附近溶液的pH升高 |
| C、放电一段时间后,K+的物质的量不变 |
| D、通甲烷的电极反应式是:CH4+8OH--8e-═CO2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com