
| A. | 用物质C表示的反应的平均速率为0.3 mol•L-1•s-1 | |
| B. | 反应开始到2 s,物质B的物质的量浓度减少了0.85 mol/L | |
| C. | 2 s时物质A的转化率为15% | |
| D. | 2v(A)=v(B) |
分析 将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中,若经2s后测得C的物质的量为0.6mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):4 2 0
变化量(mol):0.6 0.3 0.6
2s末时(mol):3.4 1.7 0.6
A.根据v=$\frac{△c}{△t}$计算v(c);
B.根据c=$\frac{n}{V}$计算2 s 时物质B的物质的量浓度减少;
C.A的转化率=$\frac{消耗A的物质的量}{A的起始物质的量}$×100%;
D.根据速率之比等于系数之比判断.
解答 解:将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中,若经2s后测得C的物质的量为0.6mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):4 2 0
变化量(mol):0.6 0.3 0.6
2s末时(mol):3.4 1.7 0.6
A.v(c)=$\frac{\frac{0.6mol}{2L}}{2s}$0.15mol/(L.s),故A错误;
B.反应开始到2s,物质B的物质的量浓度减少了$\frac{0.3mol}{2L}$=0.015mol/L,故B错误;
C.A的转化率=$\frac{0.6mol}{4mol}$×100%=15%,故C正确;
D.速率之比等于系数之比,所以v(A)=2v(B),故D错误;
故选:C.
点评 本题考查化学平衡与化学反应速率的有关计算,难度不大,侧重对基础知识的巩固,注意反应速率通常利用定义法与速率规律计算.


科目:高中化学 来源: 题型:选择题
| A. | 利用植物秸秆可以生产香料乙酸乙酯 | |
| B. | 从煤焦油中提取苯和苯的同系物,可采取的方法是萃取 | |
| C. | 用石油裂解产物通过加聚反应直接制备PVC(聚氯乙烯) | |
| D. | 油脂在氢氧化钠溶液中加热发生皂化反应,最终生成高级脂肪酸和丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
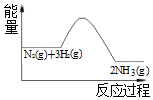
| A. | 反应体系中加入催化剂,不会改变反应的热效应 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应的热化学方程式为 3H2+N2?2NH3+Q(Q>0) | |
| D. | 该反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在c(H+)=10-13mol/L的溶液中:NH4+、Al3+、Fe3+、NO3- | |
| B. | pH值为1的溶液:Cu2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-3mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 溶有NaHSO4的溶液中:K+、SO42-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
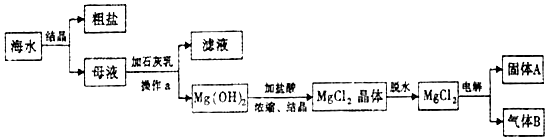
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
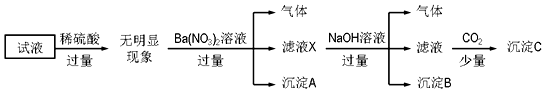
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| C. | 沉淀C为Al(OH)3 | |
| D. | 无法确定原试液中是否含有K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
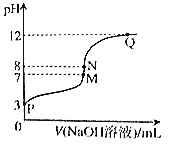 T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )
T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )| A. | T℃时,CH3COOH电离平衡常数Ka=1.0×10-3 | |
| B. | M点对应的NaOH溶液体积为20.00mL | |
| C. | N点与Q点所示溶液中水的电离程度:N>Q | |
| D. | N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com