
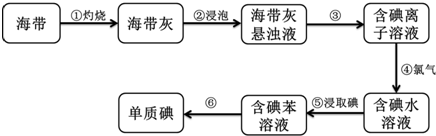
分析 (1)分离固体与液体混合物应用过滤;分离相互溶解的沸点不同的两种液体用蒸馏操作;
(2)氯气具有氧化性,能够氧化碘离子生成单质碘;过氧化氢具有氧化性,能够氧化碘离子生成单质碘,本身被还原为水;
(3)步骤⑤为萃取,依据选用萃取剂原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂,解答;
(4)淀粉遇到碘单质变蓝,可以用淀粉溶液检验碘单质的存在;
解答 解:(1)依据流程图可知:操作③前为海带灰悬浊液,操作③后为含碘离子的溶液,可知操作③为分离固体与液体的操作,为过滤;
依据流程图可知:操作⑥前为含碘的苯溶液,操作⑥后为单质碘,单质碘易溶于苯,二者沸点不同,分离二者应选择蒸馏,所以操作⑥为蒸馏;
故答案为:过滤;蒸馏;
(2)氯气具有氧化性,能够氧化碘离子生成单质碘,离子方程式:2I-+Cl2=I2+2Cl-;过氧化氢具有氧化性,能够氧化碘离子生成单质碘,本身被还原为水,离子方程式:H2O2+2I-+2H+=I2+2H2O;
故答案为:2I-+Cl2=I2+2Cl-;H2O2+2I-+2H+=I2+2H2O;
(3)选用的萃取剂的原则:①和原溶液中的溶剂互不相溶; ②对溶质的溶解度要远大于原溶剂.
步骤⑤为萃取,选择用苯来提取碘的理由是:碘在苯中的溶解度比在水中溶解度大得多,苯与水互不相溶;
故答案为:碘在苯中的溶解度比在水中溶解度大得多,苯与水互不相溶;
(4)碘遇到淀粉变蓝,检验方法:取少量提取碘后的溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果出现蓝色,说明含有单质碘;
故答案为:取少量提取碘后的溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果出现蓝色,说明含有单质碘.
点评 本题考查从海带中提取碘的有关实验设计与探究,涉及物质的制备、分离与提纯,明确卤族元素对应物质的性质,熟悉萃取、蒸馏的实验原理和操作是解题关键,侧重考查学生分析能力和解决问题能力,题目难度中等.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| C. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
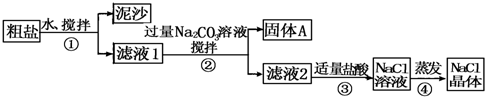
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | 有气泡冒出且烧杯中产生白色沉淀 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,加入硝酸酸化的硝酸钡溶液 | 产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
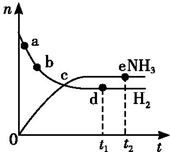 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )| A. | c点表示NH3生成速率与NH3分解速率相等 | |
| B. | c点和e点H2的转化率相等 | |
| C. | 平衡后再升高温度,不利于氨的合成 | |
| D. | d点时:n(H2):n(NH3)=3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 当容器中气体压强不变时,反应达到平衡 | |
| C. | 升高温度,平衡逆向移动 | |
| D. | 改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com