
| 目前空气的主要成分 | N2、O2、CO2、水蒸气及稀有气体He、Ne等 |
| 原始大气的主要成分 | CH4、NH3、CO、CO2等 |
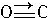 ,与CO结构最相似的分子是______(填写化学式),这两种结构相似的分子中,分子的极性______(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫______键.
,与CO结构最相似的分子是______(填写化学式),这两种结构相似的分子中,分子的极性______(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个不同,它叫______键.
 可知分子含有1个配位键,2个共价键,
可知分子含有1个配位键,2个共价键,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CS2分子的立体结构为V形 |
| B.SiF4和SO32-的中心原子均为sp2杂化 |
| C.SF6中有6对完全相同的成键电子对 |
| D.ClO3-的空间构型为平面三角形 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分子中Si60被包裹在C60里面 | B.形成的晶体属于分子晶体 |
| C.其摩尔质量为2400 | D.熔点高、硬度大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石墨烯与石墨互为同位素 |
| B.0.12g石墨烯中含有6. 02×1022个碳原子 |
| C.石墨烯是一种有机物 |
| D.石墨烯中的碳原子间以共价键结合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
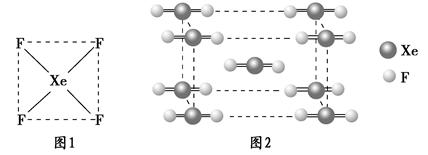
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2 852 | 2 072 | 714 | 190(2.6×105Pa) |
| 沸点/℃ | 3 600 | 2 980 | 1 412 | 182.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com