
【题目】按要求完成下列题目:
(1)写出用Na2O2与水的化学方程式:__________________________________
(2)写出Fe在Cl2中燃烧化学方程式:__________________________________
(3)写出用Cl2与NaOH制消毒液的离子方程式:______________________________
(4)写出NaHCO3电离方程式:___________________________________
(5)写出氢氧化钠溶液与稀硫酸反应的离子方程式__________________
【答案】2Na2O2+2H2O=4NaOH+O2↑ 2Fe + 3Cl2 ![]() 2FeCl3 2OH-+ Cl2 = ClO-+Cl-+H2O NaHCO3=Na++HCO3- H++OH-= H2O
2FeCl3 2OH-+ Cl2 = ClO-+Cl-+H2O NaHCO3=Na++HCO3- H++OH-= H2O
【解析】
(1) Na2O2与水反应生成氢氧化钠和氧气,其化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;
(2) Fe在Cl2中燃烧生成最高价氯化物,其化学方程式为:2Fe + 3Cl2 ![]() 2FeCl3;
2FeCl3;
(3)写出用Cl2与NaOH反应生成氯化钠、次氯酸钠和水,其离子方程式为:2OH-+ Cl2 = ClO-+Cl-+H2O;
(4) NaHCO3为强电解质,在水中会完全电离,其电离方程式:NaHCO3=Na++HCO3-;
(5)氢氧化钠溶液与稀硫酸发生中和反应,其离子方程式为:H++OH-= H2O。


 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:

(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量________(填“大于”“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:______。甲醇分子中的化学键类型是____(填“离子键”或“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是________,发生的是________(填“氧化”或“还原”)反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:_______。
(5)下列事实能表明该反应已达平衡状态的是________(填序号)。
A. CO2(g)的浓度不再发生变化
B. 单位时间内消耗1mol CO2的同时生成3mol H2
C. 在一个绝热的容器中,混合物的温度不再发生变化
D. 在一个容积固定的容器内,压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中所用的氯气是用下列方法制取的:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,一次实验中,用过量的浓盐酸(其密度为1.19g/mLHCl的质量分数为36.5%)跟一定量的二氧化锰反应,二氧化锰完全溶解,产生了5.6L(标准状况下)的氯气。试计算:
MnCl2+Cl2↑+2H2O,一次实验中,用过量的浓盐酸(其密度为1.19g/mLHCl的质量分数为36.5%)跟一定量的二氧化锰反应,二氧化锰完全溶解,产生了5.6L(标准状况下)的氯气。试计算:
(1)浓盐酸的物质的量浓度_____;
(2)反应的HCl的物质的量____;
(3)二氧化锰的质量______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成左、右两室,左室充入等物质的量的氢气和氧气,右室充入一氧化碳和氧气的混合气。同时引燃左右两室的混合气,反应后恢复到室温。反应前后活塞位置如下图所示,则右室混合气体中一氧化碳和氧气的物质的量之比可能是(液态水的体积忽略不计)

①1:1 ②1:2 ③1:3 ④3:1
A. ①② B. ②④ C. ①④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图所示,X、Y的核外电子数之和等于W的核外电子数,下列说法不正确的是( )
![]()
A.X、Y、Z三种元素的最高正价依次增大
B.Y、Z形成的简单氢化物,后者稳定性强
C.Y、Z形成的简单阴离子,后者半径小
D.工业上用电解W和Z形成的化合物制备单质W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH,作为H+和OH离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HCl,其工作原理如图所示,M、N为离子交换膜。下列说法不正确的是( )
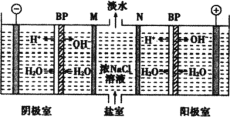
A.相同条件下,不考虑气体溶解,阴极得到气体体积是阳极两倍
B.电解过程中Na+向左迁移,N为阴离子膜
C.若去掉双极膜(BP),阳极室会有Cl2生成
D.电解结束后,阴极附近溶液酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工发展水平。以A原料衍生出部分化工产品的反应流程如下(部分反应条件已略去):
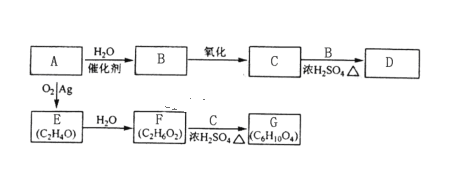
已知:①2RCHO+O2![]() 2RCOOH;②R-CH=CH-OH烯醇式的结构不能稳定存在。请回答下列问题:
2RCOOH;②R-CH=CH-OH烯醇式的结构不能稳定存在。请回答下列问题:
(1)A的电子式为___。
(2)B、D分子中的官能团名称分别是____、____。
(3)C和B反应生成D的化学方程式为________。
(4)E的结构简式为_____。
(5)结合题意,写出E可能的同分异构体的结构简式_____。
(6)F和C反应生成G的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】薄荷油中含有少量的α非兰烃和β非兰烃,两者互为同分异构体,其相对分子质量为136。根据如下转化,回答相关问题:
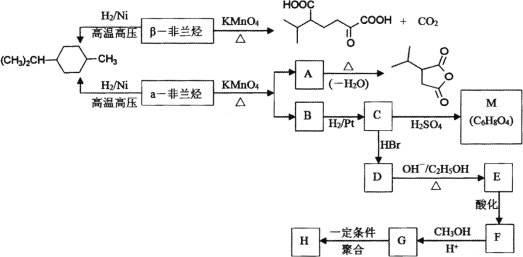
已知:
![]()
![]()
![]() +RCHO
+RCHO
![]()
![]()
![]() +CO2
+CO2
2CH3COOH![]()
![]()
(1) 写出α非兰烃中官能团名称________,β非兰烃的结构简式________。
(2) 下列有关说法正确的是________。
A.α非兰烃与等物质的量的Br2进行加成反应,产物共有3种
B.C→D和E→F反应类型相同
C.聚合物H易溶于水
D.C→M反应过程中有高分子聚合物等副产物产生
(3) 写出F→G的化学方程式________。
(4) 写出符合下列条件的A的同分异构体________。
①含有4个-CH3;②1 mol此同分异构体在碱性条件下水解需2 mol NaOH。
(5) 以甲苯和丙烯为基本原料合成![]() (用流程图表示,其他无机试剂任选)________。
(用流程图表示,其他无机试剂任选)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠和碳酸氢钠广泛的应用于我们的生产和生活中。请回答下列问题。
(1)NaHCO3是膨松剂必不可少的成分,受热时能使面胚在焙烧过程中变得松软、多孔。写出受热时NaHCO3发生反应的化学方程式___。
(2)请根据厨房中的物质,设计一实验鉴别某白色粉末是食盐还是食用碱(主要成分为Na2CO3)___。
(3)如图是某兴趣学习小组设计的验证Na2CO3比NaHCO3热稳定性强的实验装置。

①乙处盛放固体药品的化学式是___;②变浑浊的是___烧杯中的澄清石灰水。
(4)兴趣学习小组为研究膨松剂在加热情况下放出气体的量,即:根据单位质量膨松剂产生CO2气体的量来判定其膨胀效果,设计了以下实验,并按如图装置连接(气密性良好,各装置中试剂均过量)。已知:浓硫酸常用于吸收水蒸气;碱石灰是固体氢氧化钠和氧化钙的混合物。回答下列问题:

①装置A中的作用为___。装置E的作用是___,
②如果去掉装置C,该实验会造成测定结果___(“偏大”、“不变”、“偏小”)
③加热前先通入一段时间的空气,再连接D装置,目的是___;停止加热后,还要继续通入一段时间的空气,这样做的目的是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com