
【题目】已知 NA是阿伏加德罗常数的值,下列说法正确的是
A.32gS8与 S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
B.1L0.1mol L-1H2C2O4溶液中含 C2O42- 离子数为0.1NA
C.2molNO与 2molO2在密闭容器中充分反应,转移的电子数为 8NA
D.标准状况下 22.4L氯气与甲烷的混合气体,光照时充分反应生成 HCl分子数为NA
【答案】A
【解析】
A.S8与 S6(![]() )分子中分别含有8个和6个S-S键,1个S对应1个S-S共价键,由于32 g S8与S6(
)分子中分别含有8个和6个S-S键,1个S对应1个S-S共价键,由于32 g S8与S6(![]() )的混合物中含硫为1mol,则该混合物中含1mol S-S键,A选项正确;
)的混合物中含硫为1mol,则该混合物中含1mol S-S键,A选项正确;
B.因为草酸是弱电解质,部分电离出C2O42-,所以L 0.1 mol·L1 H2C2O4溶液含C2O42- 离子数小于0.1NA,B选项错误。
C.密闭容器中2 mol NO与2mol O2充分反应,这是一个可逆,转移的电子数小于4NA,由于NO不足,更小于8NA,C选项错误;
D.在标准状况下,22.4 L氯气与甲烷混合气体,光照时充分反应,由于无法知道氯气、甲烷各为多少量,所以生成HCl分子数无法计算,D选项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】碳、氮、硫的化合物在生产生活中广泛存在。请回答:
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ΔH=-160.5kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式__。
(2)T温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。不同时刻测得容器中n(NO2)如下表:
2NO2(g) H<0。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①升高温度K值___(增大、减小),T温度时化学平衡常数K=___mol-1·L
②从0~2s该反应的平均速率v(NO2)=___。
③对可逆反应2NO(g)+O2(g)![]() 2NO2(g) H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___。
2NO2(g) H<0。恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是___。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.氧气的转化率不再变化
D.N2、O2、NO的物质的量之比为1:1:2
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是___(写出主要反应的离子方程式),该溶液中,c(Na+)___2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
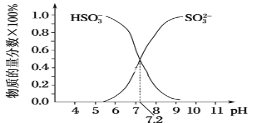
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的第一步水解平衡常数=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是将化学能转化为电能的装置。

I. a为铜片,b为铁片,烧杯中是稀硫酸溶液
(1)当开关K断开时产生的现象为_______ ;当开关K闭合时,产生的现象为_________。
A.a不断溶解 B.b不断溶解 C.a上产生气泡 D.b上产生气泡 E.溶液逐渐变蓝
(2)闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述不正确的是___________ 。
A.溶液中H+浓度减小 B.正极附近![]() 浓度逐渐增大
浓度逐渐增大
C.溶液中含有FeSO4 D.溶液中![]() 浓度基本不变
浓度基本不变
II.FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为 ________ ,若将此反应设计成原电池,请写出该原电池负极电极反应为_______,正极电极反应为______。
III.如图是氢氧燃料电池构造示意图。

下列说法不正确的是______
A.a极是负极
B.电子由b通过溶液流向a
C.该电池总反应是2H2+O2=2H2O
D.氢氧燃料电池是环保电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产生活等各个领域有着广泛的应用。
(1)钛具有良好的金属性能。钛基态原子中电子占据能级个数为______。与钛同周期的元素中,基态原子的未成对电子数与钛相同的还有______种。钛比钢轻、比铝硬,是一种新兴的结构材料,钛硬度比铝大的可能原因是________。
(2)有一种氮化钛晶体的晶胞与NaCl晶胞相似,该晶胞中N、Ti之间的最近距离为a×10-10cm,则该氮化钛的密度为_________g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。
(3)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。Li2O是尚子晶体,其晶格能可通过图(a)的Bom-Haber循环计算得到。
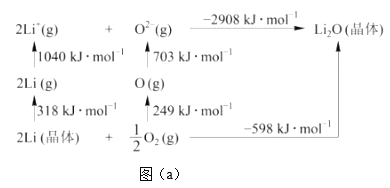
Li原子的第一电离能为______kJ·mol-1,O==O键键能为______kJ·mol-1,Li2O晶格能为_______kJ·mol-1。
(4)Zn可形成多种化合物,其中立方ZnS晶胞结构如下图,其阴离子(S2-)按面心立方密堆积排布,立方ZnS的配位数与NaCl不同,这是由__________因素决定的。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 异丙基的结构简式:-CH(CH3)2
C. 羟基的电子式: ![]() D. 新戊烷的结构简式:
D. 新戊烷的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质:
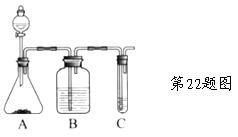
(1)实验室制备乙炔的化学方程式是_______________________________;
(2)实验过程中,为减缓生成乙炔的速率,通常采取的措施是:___________________________________________________________;
(3)B中试剂是 ;
(4)若C中试剂是溴水,可以观察到的现象是_________________。
Ⅱ.利用上述装置还可以验证醋酸、苯酚、碳酸的酸性强弱。
(1)A中固体试剂是 (选填序号);
A.醋酸钠 B.碳酸氢钠 C.苯酚钠
(2)C中反应的化学方程式是____________________________________;
(3)有同学认为没有B装置,也可以验证酸性的强弱,你认为合理吗?
_____(填“合理”或“不合理”);若不合理,原因是:
______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
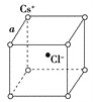
【题目】如图是氯化铯晶体的晶胞(晶体中的最小重复单元),已知晶体中两个最近的Cs+离子核间距离为a cm,氯化铯的相对分子质量为M,NA为阿伏加德罗常数,则氯化铯晶体密度是( )
A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是( )
A. ![]() 溶液中:
溶液中:![]()
B. ![]() 溶液中:
溶液中:![]()
C. ![]() 弱酸
弱酸![]() 与
与![]() 溶液等体积混合的溶液中:
溶液等体积混合的溶液中: ![]()
D. ![]() 溶液与同浓度等体积盐酸混合的溶液中:
溶液与同浓度等体积盐酸混合的溶液中:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com