
【题目】己二酸![]() 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:![]()
可能用到的有关数据如下:
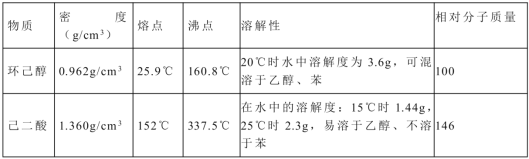
实验步骤如下:
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65 ℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃-90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
Ⅴ、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1)滴液漏斗的细支管a的作用是________,仪器b的名称为________。
(2)己知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2 +NaNO3 +H2O
NO+NO2+2NaOH =2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_________________、__________________;
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果:_________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
【答案】
(1)平衡滴液漏斗与三口烧瓶内的压强,使环己醇能够顺利流下,球形冷凝管(或冷凝管)
(2)2NO2+Na2CO3═NaNO2+NaNO3+CO2,NO+NO2+Na2CO3═2NaNO2+CO2
(3)反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中
(4)苯(5)重结晶,75%
【解析】
试题分析:(1)滴液漏斗的细支管a的作用是平衡滴液漏斗与三口烧瓶内的压强,使环己醇能够顺利流下;该仪器有球形区域,仪器b的名称为:球形冷凝管(或冷凝管),冷水从冷凝管下口入,上口出,克服重力充满冷凝管,冷凝效果好;
(2)根据元素守恒,纯碱与NO和NO2反应,生成NaNO2、NaNO3,且放出CO2,反应的化学方程式为①NO+NO2+Na2CO3═2NaNO2+CO2,②Na2CO3+2NO2═NaNO2+NaNO3+CO2;
(3)向三口烧瓶中滴加环己醇时,反应温度迅速上升,说明该反应为放热反应,需控制好环己醇的滴入速率,如果环己醇的滴入速率过快,反应温度高,反应液暴沸冲出冷凝管;可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中;
(4)产品己二酸中含有环己醇、硝酸等杂质,己二酸在水中的溶解度:15℃时1.44g,25℃时2.3g,温度高溶解度大,可用冰水洗涤,除去环己醇、硝酸,己二酸不溶于苯,最后用苯洗涤晶体,除去表面的杂质,避免产品损失;
(5)粗产品再溶解,再结晶析出,通过重结晶的方法提纯己二酸,
![]()
3×100 3×146
5.1948g m
m=7.58g
己二酸产率=![]() ×100%=75%。
×100%=75%。


科目:高中化学 来源: 题型:
【题目】化学课外兴趣小组学生在实验室里制取的乙烯中长混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题
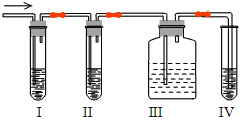
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是I ;Ⅱ ;Ⅲ ;Ⅳ 。依次填为( )
①品红溶液 ②NaOH溶液 ③浓硫酸 ④酸性KMnO4溶液
A.④②①③ B.①②①③ C.①②①④ D.④②①④
(2)能说明SO2气体存在的现象是____________。
(3)使用装置Ⅲ的目的是____________。
(4)确定含有乙烯的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将NO2 转化为重要化工原料C。
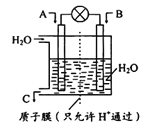
若A为NO2,B为O2,则负极的电极反应式为______________________________;
(2)有一种用CO2生产甲醇燃料的方法:
CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
H2O(g)=H2O(l) △H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_________________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) ![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
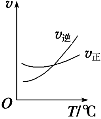
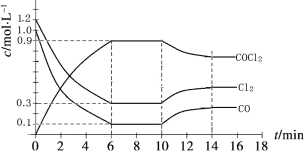
①0~6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7min 向体系中加入这三种物质各2mol,则平衡向____________________
移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、c(COCl2)_________ mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是__________;(填“增大”、“减小”或“不变”)
⑤比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)_______T(15)(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素⑧的名称是______,元素⑧在周期表中所处位置___________。元素④的氢化物沸点高于⑦的氢化物沸点,原因是_________________________________________。
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是________________________(写氢化物的化学式)。
(3)元素②④形成原子个数比为1:2的化合物的电子式是 。
(4)元素②形成的一类氢化物称为烷烃,通式是___________,其中 (填分子式)有两种同分异构体,结构简式分别是____________________________________。
(5)用电子式表示⑤与⑦形成化合物的过程_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2 L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
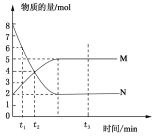
(1)写出此反应的化学方程式________________________。
(2)下列叙述中能说明上述反应达到平衡状态的是_____。
A.反应中M与N的物质的量之比为1:1
B.在混合气体中N的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的压强不随时间的变化而变化
(3)若t3=3,则3min内用M表示的反应速率是 。
(4)在t2时刻正反应速率v(正)与逆反应速率v(逆)的大小关系是 。
(5)反应达到平衡后,N所占的体积分数是 (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为________。
(2)Fe2O3是主氧化剂,与Na发生置换反应生成的还原产物为________。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为________,金属晶体K的堆积方式为________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为______
__________________________________。
(5)100 g上述产气药剂产生的气体通过碱石灰后得到N2 33.6 L(标准状况)。
①用碱石灰除去的物质为________________;
②该产气药剂中NaN3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸:
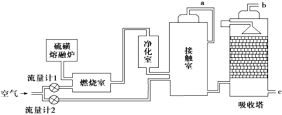
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣;3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2![]() KI3
KI3
某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
(1)①第一份试液中滴加KSCN溶液显红色,该红色物质是 (用化学式表示);
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)①KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境下KI与氧气反应的化学方程式: 。
②将I2溶于KI溶液,在低温条件下,可制得KI3H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 。
(3)现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加KBrO3的物质的量的关系如图所示。请回答下列问题:
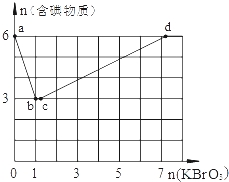
①已知b点时,KI反应完全,转移的电子数为 。
②b→c过程中,仅有一种元素的化合价发生了变化.则反应时氧化剂与还原剂的物质的量之比为 。
③d点时,n(KBrO3)为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如下图所示。
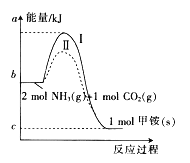
(1)图中反应为可逆反应,则生成甲铵的反应是 (填“放热”或“吸热”)反应。
(2)合成甲铵的热化学方程式为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,其原因是 。
(4)已知由甲铵合成尿素的反应为NH2COONH4(s)![]()
![]() ;
;![]() ,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为 。
,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com