考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:
分析:A.溶液中c(H
+)=10
-pH;
B.醋酸是弱电解质,HCl是强电解质,pH相等的醋酸和盐酸,醋酸物质的量浓度大,氢离子浓度越大,反应速率越快;
C.pH=10的NaOH溶液中c(OH
-)=10
-4 mol/L、pH=12的NaOH的溶液c(OH
-)=10
-2mol/L,等体积混合后,溶液中c(OH
-)=
mol/L,混合溶液中c(H
+)=
mol/L;
D.pH=11的氢氧化钠溶液浓度为10
-3mol/L,pH=3的HA溶液浓度≥10
-3mol/L,二者混合后溶液呈中性,如果HA是强酸,二者体积相等,如果是弱酸,则NaOH溶液体积大于HA.
解答:
解:A.溶液中c(H
+)=10
-pH,pH=2的可乐中c(H
+)=10
-2mol/L、pH=3的柠檬水中10
-3mol/L,所以pH=2的可乐中c(H
+)是pH=3的柠檬水中c(H
+)的10倍,故A正确
B.醋酸是弱电解质,HCl是强电解质,pH相等的醋酸和盐酸,醋酸物质的量浓度大,氢离子浓度越大,反应速率越快,反应过程中醋酸继续电离出氢离子,所以醋酸反应速率大于稀盐酸,与等量的镁反应,稀盐酸用时间长,故B错误;
C.pH=10的NaOH溶液中c(OH
-)=10
-4 mol/L、pH=12的NaOH的溶液c(OH
-)=10
-2mol/L,等体积混合后,溶液中c(OH
-)=
mol/L,混合溶液中c(H
+)=
mol/L=
mol/L=2×10
-12mol/L,所以溶液的pH为11.7,故C错误,
D.pH=11的氢氧化钠溶液浓度为10
-3mol/L,pH=3的HA溶液浓度≥10
-3mol/L,二者混合后溶液呈中性,如果HA是强酸,二者体积相等,如果是弱酸,则NaOH溶液体积大于HA,所以溶液的体积V
1≥V
2,故D错误;
故选A.
点评:本题考查弱电解质的电离,侧重考查酸碱混合溶液定性判断、pH的计算、反应速率的影响因素等知识点,明确弱电解质电离特点是解本题关键,注意反应速率与离子浓度成正比,与电解质强弱无关,易错选项是B.



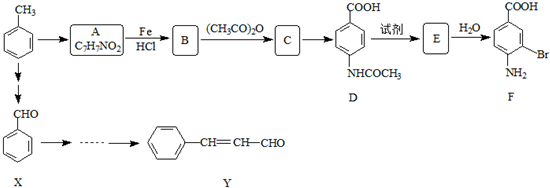
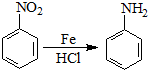

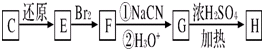
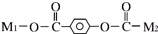 (其中M1、M2代表未知部分的结构),它在一定条件下可以发生如下转化:
(其中M1、M2代表未知部分的结构),它在一定条件下可以发生如下转化: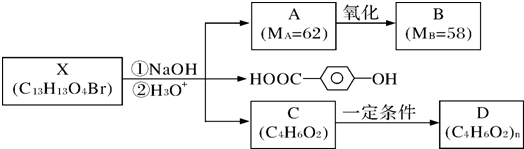
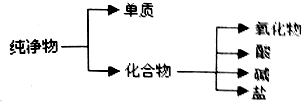 纯净物根据其组成和性质可进行如图所示分类
纯净物根据其组成和性质可进行如图所示分类