
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
【答案】 碱性溶液吸收了空气中的CO2 OH- + H3AsO3![]() H2AsO3- + H2O 2.2 在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加 在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷
H2AsO3- + H2O 2.2 在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,静电斥力增加 在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小 加入氧化剂,将三价砷转化为五价砷
【解析】(1)NaOH在空气中易与CO2反应生成NaCO3,吸附剂X中含有![]() ,其原因是碱性溶液吸收了空气中的CO2 ;(2)①从题20图-1可知pH由小变大时, H3AsO3浓度减小,H2AsO3-浓度增大,当溶液由无色变为浅红色时,主要反应的离子方程式为OH- + H3AsO3
,其原因是碱性溶液吸收了空气中的CO2 ;(2)①从题20图-1可知pH由小变大时, H3AsO3浓度减小,H2AsO3-浓度增大,当溶液由无色变为浅红色时,主要反应的离子方程式为OH- + H3AsO3![]() H2AsO3- + H2O ;②H3AsO4第一步电离方程式H3AsO4
H2AsO3- + H2O ;②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,Ka1=
H2AsO4-+H+的电离常数为Ka1,Ka1=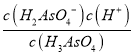 ,由题20图-2读出:,
,由题20图-2读出:, ![]() =
= ![]() ,
, ![]() =10-2.2mol/L,Ka1=
=10-2.2mol/L,Ka1= ![]() =10-2.2mol/L,p Ka1 = -lg Ka1 =-lg10-2.2=2.2;(3)①在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,,静电斥力增加,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降。②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小。提高吸附剂X对三价砷去除效果可采取的措施是:加入氧化剂,将三价砷转化为五价砷。
=10-2.2mol/L,p Ka1 = -lg Ka1 =-lg10-2.2=2.2;(3)①在pH7~9之间,随pH升高H2AsO4-转变为HAsO42-,吸附剂X表面所带负电荷增多,,静电斥力增加,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降。②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4-和HAsO42-阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小。提高吸附剂X对三价砷去除效果可采取的措施是:加入氧化剂,将三价砷转化为五价砷。


科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是 ( )
A. 溴水中有平衡:Br2+ H2O ![]() HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO,当加入 AgNO3溶液后,溶液颜色变浅
B. 对CO(g) + NO2 (g) ![]() CO2 (g)+ NO(g),平衡体系增大压强可使颜色变深
CO2 (g)+ NO(g),平衡体系增大压强可使颜色变深
C. 新制的氯水在光照下颜色变浅
D. 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应N2 (g) +3H2 (g) ![]() 2NH3 (g)的ΔH < 0,ΔS >0
2NH3 (g)的ΔH < 0,ΔS >0
B. 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
C. 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2B.X2YZ3C.X2YZ2D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=+489.0 kJ·mol-1 C(石墨)+CO2(g)=2CO(g) △H2=+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为____________。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H

①该反应的平衡常数表达式为K=__________。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH_____0(填“>”、“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ_____KⅡ(填“>”、“<”或“=”)。

(3)以CO2为原料还可以合成多种物质,用硫酸溶液作电解质进行电解,CO2在电极上可转化为CH4,该电极应与电源 ___________(填“正极”、“负极”)相连,其电极反应的方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:

回答下列问题:
(1)A的分子式为____________。
(2)D中含有的官能团是____________,分子中最多有____________个碳原子共平面。
(3)①的反应类型是____________,③的反应类型是____________。
(4)⑤的化学方程式为_______________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]()
的合成路线:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种无色液态物质:①己烯[![]() ]、②己烷[CH3(CH2)4CH3]、③苯(
]、②己烷[CH3(CH2)4CH3]、③苯(![]() )、④甲苯(
)、④甲苯(![]() )。
)。
(1)不能与溴水和酸性KMnO4溶液反应,但在铁屑作用下能与液溴反应的是_____(填序号,下同),生成的有机物是____(填名称),反应的化学方程式为__________,此反应属于________反应。
(2)能与溴水和酸性KMnO4溶液反应的是____,与溴水反应的化学方程式是____,此反应属于____反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中的两种物质所含有原子总数目相等的是( )
A. 3mol H2O2 2mol NH4Cl B. 18gH2O 18gCO2
C. 1L CO2 1LCH4 D. 2mol/L HCl 2mol/L HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com