
【题目】下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是

A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
【答案】B
【解析】
候氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3;在这一实验过程中,由于C02在水中的溶解度较小,而NH3的溶解度较大,为防止倒吸,b管通C02,a管通NH3,所以要向食盐水中先通NH3再通C02,否则C02通入后会从水中逸出,再通NH3时溶液中C02的量很少,得到的产品很少;在这个实验中的尾气主要是C02和NH3,其中NH3对环境影响较大,要进行尾气处理,而NH3是碱性气体,所以在c装置中要装酸性物质,据此进行推断。
“侯氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3,为防止倒吸,a管通NH3,b管通C02;由于C02在水中的溶解度较小,而NH3的溶解度较大,所以要在食盐水先通NH3然后再通C02,否则C02通入后会从水中逸出,等再通NH3时溶液中C02的量就很少了,这样得到的产品也很少,氨气是碱性气体,可以用蘸稀硫酸的脱脂棉吸收氨气,防止污染空气,答案选B。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】配制2mol/L的NaCl溶液950mL时应选用的容量瓶的规格和NaCl质量分别是( )
A.950mL 111.2g
B.1000mL 117g
C.1000mL 111.2g
D.950mL 117g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2HI(g) ![]() H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
H2(g) +I2(g),下列叙述能够说明己达平衡状态的是
A. 混合气体的颜色不再变化
B. 温度和体积一定时,容器内压强不再变化
C. lmolH-H键生成的同时有2molH-I键断裂
D. 各物质的物质的量浓度之比为2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为__________________。
(2)乙元素在周期表中的位置为__________________。
(3)丙元素的最高价氧化物的电子式为__________________。
(4)甲与丁两种元素可组成的具有强氧化性的物质是__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
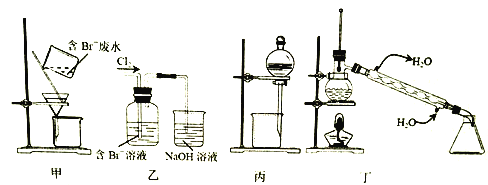
下列说法正确的是
A. 用甲装置过滤时,需不断搅拌
B. 丙装置中用正十二烷而不用CCl4,是因为其密度小
C. 用乙装置将Br-氧化为Br2
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A. 水的电离程度始终增大
B. ![]() 先增大再减小
先增大再减小
C. c(CH3COOH)与c(CH3COO-)之和始终保持不变
D. 当加入氨水的体积为10 mL时,c (NH4+)=c(CH3COO-)
【答案】D
【解析】试题分析:A、CH3COOH属于弱酸,抑制水的电离,加入NH3·H2O,消耗CH3COOH,水的电离程度增大,但氨水过量后,对水电离抑制,故错误;B、当向CH3COOH溶液中滴加相同浓度的NH3·H2O,开始时溶液为CH3COOH和CH3COONH4的混合物,由CH3COONH4的水解常数Kh=[c(H+)×c(NH3·H2O)]/c(NH4+),随着氨水的加入,c(H+)逐渐减小,Kh不变,因此c(NH4+)/c(NH3·H2O)变小,当氨水至溶液显碱性时,氨水的电离常数Kb=[c(OH-)×c(NH4+)]/c(NH3·H2O),随着氨水的加入,c(OH-)逐渐增大,Kb不变,c(NH4+)/c(NH3·H2O)变小,因此此比值始终变小;C、根据物料守恒,n(CH3COOH)+n(CH3COO-)=0.001mol,由于溶液体积逐渐增大,因此c(CH3COOH)和c(CH3COO-)之和逐渐减小,故错误;D、当加入氨水的体积为10mL,醋酸和NH3·H2O物质的量相等,由于二者电离常数相等,因此溶液显中性,c(H+)=c(OH-),根据电荷守恒,c(NH4+)=c(CH3COO-),故正确。
考点:考查电离平衡常数、水解平衡常数、离子浓度大小比较等知识。
【题型】单选题
【结束】
13
【题目】常温下,下列有关离子浓度及pH大小的比较,正确的是( )
A. NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,溶液浓度由大到小的顺序是:③>②>①
B. 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C. pH=13的Ba(OH)2溶液与pH=1的HCl溶液等体积混合后,混合溶液的pH>7
D. pH=12的Ba(OH)2溶液与pH=14的NaOH溶液等体积混合,混合溶液的pH范围是13<pH<14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com