
| A. | 46g乙醇中存在的共价键总数为8NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
分析 A.求出乙醇的物质的量,然后根据乙醇中含8条共价键来分析;
B.溶液体积未知;
C.求出混合物的物质的量,然后根据1mol氢气和1molCO燃烧时均消耗0.5mol氧气来分析;
D.该反应中,4mol氯气反应生成6molNaCl,转移了6mol电子,据此计算出消耗1mol氯气转移的电子数.
解答 解:A.46g乙醇的物质的量为1mol,而乙醇中含8条共价键,故含8NA条,故A正确;
B.溶液体积未知,无法计算微粒个数,故B错误;
C.标况下8.96L混合物的物质的量为0.4mol,而1mol氢气和1molCO燃烧时均消耗0.5mol氧气,故0.4mol混合气体燃烧消耗0.2mol氧气,与两者的比例无关,故C正确;
D.反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O转移6mol电子,消耗4mol氯气,故当消耗1mol氯气时转移1.5mol电子即1.5NA个,故D正确;
故选:B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,明确好以物质的量为中心的各化学量与阿伏加德罗常数的关系为解答关键,注意乙醇结构特点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
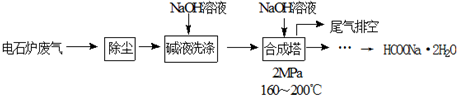
| 族 周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | He |
| 2 | B | C | D | |||||
| 3 | E | F | G | H | I | J | K | L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
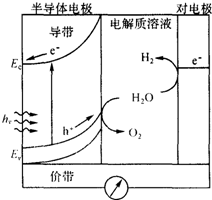 太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )
太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )| A. | 对电极表面发生的电极反应式为:4H++4e-→2H2 | |
| B. | 电池的总反应式为:2H2O$\stackrel{hv}{→}$O2+2H2↑ | |
| C. | 整个过程中实现了太阳能向电能化学能等的转化 | |
| D. | 装置中电流的方向是从半导体电极流向对电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铝溶液中加入少量的氨水:Al3++3OH-═Al(OH) 3↓ | |
| B. | 向碳酸钠溶液中加入饱和石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 向氢氧化钠溶液中通入过量的氯气:Cl2+2OH-═ClO-+Cl-+H2O | |
| D. | 向稀硫酸中加入过量铁粉,先后发生两个反应:2Fe+6H+═2Fe3++3H2↑,Fe+2Fe3+═3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
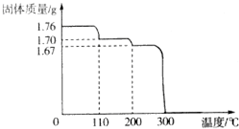 将1.76gHIO3固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:
将1.76gHIO3固体样品放在热重分析仪中进行热重分析,测得其热重分析曲线(样品质量随温度变化的曲线)如图所示:查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题

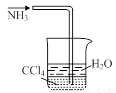
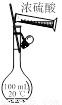
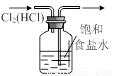
图甲 图乙 图丙 图丁
A. 用图甲所示装置验证反应产物二氧化碳
B. 用图乙装置吸收氨气并防止倒吸
C. 图甲装置配制100 mL 1 mol·L-1的硫酸
D. 用图丁装置除去氯气中的氯化氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com