
| 混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
| A | c(HA)=0.02mol?L-1 | 等体积混合,pH>7 |
| B | HB溶液的pH=2 | V1 mL NaOH溶液与V2 mL HB溶液,pH=7 |
| C | c(H2C)=0.01mol?L-1 | 等体积混合,pH>7 |
| D | c(NaHD)=0.01mol?L-1 | 等体积混合,pH=7 |
| 1000 |
| 18 |
| 1000 |
| 18 |
| 10-12 | ||
|


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-3 |
| HNO3 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省龙岩市高三上学期期末考试化学试卷(解析版) 题型:填空题
X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.0 1 mol·L-1的X、Y、Z、W溶液的pH。
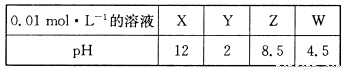
(1)X、W的化学式分别为_______、________。
(2)W的电离方程式为______________________________。
(3)25℃时,Z溶液的pH>7的原因是______________________________________(用离子方程式表示)。
(4)将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 _______________________________________________________ 。
(5)Z溶液与W溶液混合加热,可产生一种无色无味的单质气体,该反应的化学方程式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
| A | c(HA)=0.02mol-L-1 | 等体积混合,pH>7 |
| B | HB溶液的pH=2 | V1 mL NaOH溶液与V2 mL HB溶液,pH=7 |
| C | c(H2C)=0.01mol-L-1 | 等体积混合,pH>7 |
| D | c(NaHD)=0.01mol-L-1 | 等体积混合,pH=7 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省吉安市吉州区白鹭洲中学高二(上)期中化学试卷(理科)(解析版) 题型:填空题
| 混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
| A | c(HA)=0.02mol?L-1 | 等体积混合,pH>7 |
| B | HB溶液的pH=2 | V1 mL NaOH溶液与V2 mL HB溶液,pH=7 |
| C | c(H2C)=0.01mol?L-1 | 等体积混合,pH>7 |
| D | c(NaHD)=0.01mol?L-1 | 等体积混合,pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com