
分析 (1)根据题意计算32.64g铜的物质的量,在反应中Cu失去的电子的物质的量即为转移电子的物质的量;
(2)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH),由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2),再根据c=$\frac{n}{V}$计算.
解答 解:(1)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,所以转移电子的物质的量是1.02mol,数目是1.02mol×6.02×1023=6.1404×1023,答:转移电子的个数6.1404×1023;
(2)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为0.5mol,
令NO和NO2的物质的量分别为xmol、ymol,则:x+y=0.5,3x+y=1.0,解得x=0.26、y=0.24,NO的体积=0.26mol×22.4L/mol=5.824L
NO2的体积=0.24mol×22.4L/mol=5.376L,
答:NO的体积为5.824L,NO2的体积为5.376L;
(3)加入氢氧化钠恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,根据钠离子守恒有:n(NaNO3)=n(NaOH)=V×10-3L×amol/L=aV×10-3 mol,由N原子守恒可知:n(HNO3)=n(NaNO3)+n(NO和NO2)=aV×10-3 mol+0.5mol=(aV×10-3+0.5)mol,故硝酸的物质的量浓度=$\frac{aV×1{0}^{-3}+0.5}{0.14}$mol/L=$\frac{0.1aV+50}{14}$mol/L,
答:原硝酸溶液的浓度为$\frac{0.1aV+50}{14}$mol/L.
点评 本题考查化学方程式计算,难度不大,注意利用氧化还原反应规律以及元素守恒思想进行解答是关键.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 半径:r(X2-)>r(Y+) | B. | 沸点:H2Z>H2X | C. | 稳定性:H2Z>HW | D. | 熔点:Y2X>Y2Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | 实验结论或目的 | 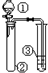 | |
| A | 浓盐酸 | KMnO4 | 石蕊试液 | 氯气的水溶液有酸性、漂白性 | |
| B | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| C | 硝酸 | Na2CO3溶液 | Na2SiO3溶液 | 比较硝酸、碳酸、硅酸酸性强弱 | |
| D | 溴水 | FeBr3、苯 | AgNO3溶液 | 苯和溴水能发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
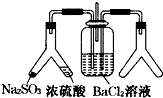
| A. | 只有①② | B. | 只有③⑤ | C. | 只有①②③ | D. | 只有①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K-、CIO-、Fe2+ | B. | OH-、Na+、Mg2+、Br- | ||
| C. | Cu2+、H+、CI-、NO3- | D. | Na+、SiO32-、Ca2+、CI- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、SO42-、OH- | B. | Ba2+、K+、Cl-、CO32- | ||
| C. | Cu2+、Ba2+、Cl-、NO3- | D. | Fe2+、H+、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.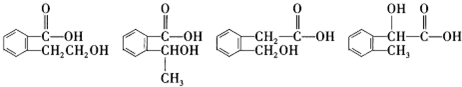 (任写两种).
(任写两种).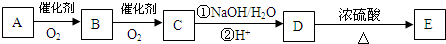
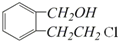 .
.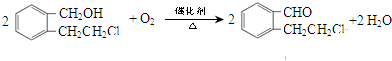 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com