
·ÖĪö £Ø1£©Ė«ŃõĖ®£ØH2O2£©ŹĒĒæŃõ»Æ¼Į£¬ŌŚĖįŠŌĢõ¼žĻĀŃõ»ÆFe2+Éś³ÉFe3+£»
£Ø2£©øł¾ŻŌŚpHĪŖ4”«5µÄĢõ¼žĻĀFe3+¼øŗõČ«²æĖ®½āÉś³ÉFe£ØOH£©3·ÖĪö£»
£Ø3£©Ź¹ÓĆpHŹŌÖ½²ā¶ØČÜŅŗµÄpHÖµŹ±£¬ŹŌÖ½²»ÄÜŹŖČó£¬ÓĆ²£Į§°ōÕŗČ”£»
£Ø4£©CuCl2Ņ×Ė®½āÉś³ÉCu£ØOH£©2£¬¼ÓČČČÜŅŗ£¬æÉŅŌ“Ł½ųĖ®½āĘ½ŗāÕżĻņŅĘ¶Æ£®
½ā“š ½ā£ŗ£Ø1£©Ė«ŃõĖ®£ØH2O2£©ŹĒĒæŃõ»Æ¼Į£¬ŌŚĖįŠŌĢõ¼žĻĀŃõ»ÆFe2+Éś³ÉFe3+£¬
·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2Fe2++H2O2+2H+=2Fe3++2H2O£¬
¹Ź“š°øĪŖ£ŗ2Fe2++H2O2+2H+=2Fe3++2H2O£»
£Ø2£©ŌŚpHĪŖ4”«5µÄĢõ¼žĻĀFe3+¼øŗõČ«²æĖ®½āÉś³ÉFe£ØOH£©3£¬CuO¹żĮ棬Ōņ£©¢ŪÖŠ¹żĀĖŗóĀĖŌüµÄ³É·ÖŹĒFe£ØOH£©3ÓėCuO£¬
¹Ź“š°øĪŖ£ŗFe£ØOH£©3ÓėCuO£»
£Ø3£©Ź¹ÓĆpHŹŌÖ½²ā¶ØČÜŅŗµÄpHÖµŹ±£¬ŹŌÖ½²»ÄÜŹŖČó£¬ÓĆ²£Į§°ōÕŗČ”£¬Óė±ź×¼±ČÉ«æØĻą±Č£¬
¹Ź“š°øĪŖ£ŗČ”Ņ»Š”æépHŹŌÖ½£¬·ÅŌŚ²£Į§Ę¬ÉĻ£¬ÓĆ²£Į§°ōÕŗČ”“ż²āŅŗ£¬µćŌŚpHŹŌÖ½ÖŠŃė£¬“ż±äÉ«ŗóÓė±ź×¼±ČÉ«æØĻą±Č£®
£Ø4£©CuCl2Ņ×Ė®½āÉś³ÉCu£ØOH£©2£¬¼ÓČČČÜŅŗ£¬æÉŅŌ“Ł½ųĖ®½āĘ½ŗāÕżĻņŅĘ¶Æ£¬ÕōøɵƵ½ĒāŃõ»ÆĶ¹ĢĢ壬²»»įµĆµ½ĀČ»ÆĶ¾§Ģå£ØCuCl2•2H2O£©£¬
¹Ź“š°øĪŖ£ŗ²»ÄÜ£»CuCl2Ņ×Ė®½āÉś³ÉCu£ØOH£©2£®
µćĘĄ ±¾Ģāæ¼²é½ĻĪŖ×ŪŗĻ£¬Éę¼°Ńõ»Æ»¹Ō·“Ó¦”¢ŃĪĄąµÄĖ®½ā”¢PHŹŌÖ½µÄŹ¹ÓƵČÖŖŹ¶£¬ĢāÄæÄѶČÖŠµČ£¬×¢Ņā°ŃĪÕ»ł“”ÖŖŹ¶µÄ»żĄŪ£®


 »„¶ÆÓ¢ÓļĻµĮŠ“š°ø
»„¶ÆÓ¢ÓļĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 90 | B£® | 100 | C£® | 114 | D£® | 132 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 mol C7H16ÖŠŗ¬ÓŠ23 mol¹²¼Ū¼ü | |
| B£® | ±ź×¼×“æöĻĀ1.12 L NH3ÖŠŗ¬ÓŠ0.5 mol e- | |
| C£® | ³£ĪĀ³£Ń¹ĻĀ0.37g 2H35ClÖŠŗ¬ÓŠ0.2molÖŠ×Ó | |
| D£® | 40 g NaOH ČÜÓŚ1 LĖ®£¬ĖłµĆČÜŅŗÖŠc£ØNa+£©=1 mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| t/”ę | 700 | 800 | 830 | 1””000 | 1””200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | $\frac{a}{2}$ mol | B£® | 2a mol | C£® | 0.1a mol | D£® | £Øa+0.1£©mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na | B£® | FeSO4 | C£® | SiO2 | D£® | Na2O2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
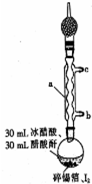 Ėĵā»ÆĪżŹĒŅ»ÖÖ³ČŗģÉ«½į¾§£¬ČŪµćĪŖ144.5”ę£¬·ŠµćĪŖ364”ę£¬²»ČÜÓŚĄäĖ®£¬ČÜÓŚ“¼”¢±½”¢ĀČ·ĀµČ£¬ÓöĖ®Ņ×Ė®½ā£¬³£ÓĆ×÷·ÖĪöŹŌ¼ĮŗĶÓŠ»śŗĻ³ÉŹŌ¼Į£®ŹµŃéŹŅÖʱøĖĵā»ÆĪżµÄÖ÷ŅŖ²½ÖčČēĻĀ£ŗ
Ėĵā»ÆĪżŹĒŅ»ÖÖ³ČŗģÉ«½į¾§£¬ČŪµćĪŖ144.5”ę£¬·ŠµćĪŖ364”ę£¬²»ČÜÓŚĄäĖ®£¬ČÜÓŚ“¼”¢±½”¢ĀČ·ĀµČ£¬ÓöĖ®Ņ×Ė®½ā£¬³£ÓĆ×÷·ÖĪöŹŌ¼ĮŗĶÓŠ»śŗĻ³ÉŹŌ¼Į£®ŹµŃéŹŅÖʱøĖĵā»ÆĪżµÄÖ÷ŅŖ²½ÖčČēĻĀ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | ŌŚpHĪŖ6.37¼°10.25Ź±£¬ČÜŅŗÖŠc£ØCO32-£©=c£ØHCO3-£©=c£ØH2CO3£© | |
| B£® | ·“Ó¦HCO3-+H2OØTH2CO3+OH- µÄĘ½ŗā³£ŹżĪŖ10-10.25 | |
| C£® | 0.1mol•L-1NaHC2O4ČÜŅŗÖŠc£ØHC2O4-£©+c£ØC2O42-£©+c£ØH2C2O4£©=0.1mol•L-1 | |
| D£® | ĶłNa2CO3ČÜŅŗÖŠ¼ÓČėÉŁĮæ²ŻĖįČÜŅŗ£¬·¢Éś·“Ó¦£ŗCO32-+H2C2O4ØTHC2O4-+HCO3- |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com