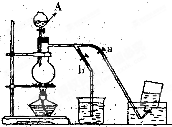
����⣺��1�����������ص��֪AΪ��Һ©������Ϊ�����ж�������Ⱦ������Ҫ����β�����գ������������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ�����Գ�������������Һ����β���У��ձ���ʢ������������Һ�գ�����ϣ��ر�a����b�����������ͨ������������Һ�������գ���ֹ��Ⱦ������Cl
2+2NaOH=NaCl+NaClO+H
2O�������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С��ʵ���ҳ����ű���ʳ��ˮ���ռ�������ʵ���ҳ��ö������̺�Ũ�����ڼ���������������������Ӧ�Ļ�ѧ����ʽΪMnO
2+4HCl
MnCl
2+Cl
2��+2H
2O��
�ʴ�Ϊ����Һ©��������ʳ��ˮ������������Һ��MnO
2+4HCl
MnCl
2+Cl
2��+2H
2O��
��2�������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С��ʵ���ҳ����ű���ʳ��ˮ���ռ��������ռ�ʱ��Ӧ�ر�b����a���ʴ�Ϊ���ر�b����a��
��3��n��Cl
2��=
=
=0.03mol��
����0.03molCl
2�μӷ�Ӧ��HCl�����ʵ���Ϊx����Ӧ�Ķ����������ʵ���ΪY��
MnO
2+4HCl
MnCl
2+Cl
2��+2H
2O
1 4 1
y x 0.03mol
x=0.12mol
y=0.03mol
��������HCl�����ʵ���=0.12mol��
=0.06mol��
�����Ϸ�Ӧ�Ķ�����������=0.03mol��87g/mol=2.61g��
�ʴ�Ϊ��2.61��0.06��
��4����ˮ��������ˮ��Ӧ��������ʹ����ᣬCl
2+H
2O=HClO+HCl��
A��ʳ�μ��룬����������Ũ�ȣ�ƽ�����ƣ�������Ũ�ȼ�С����A�����ϣ�
B��ˮ����ƽ��״̬����Ũ�ȼ�С��������Ũ�ȼ�С����B�����ϣ�
C������̼��ƺ����ᷴӦ�ٽ�ƽ��������У�������Ũ������C���ϣ�
D�������������ƻ�����ᡢ�����ᷢ����Ӧ��������Ũ�ȼ�С����D�����ϣ�
�ʴ�Ϊ��C��

 ��ͼ��ʾ��û��ͨ������������Ʊ�����ʱ��Ƶ�װ�ã�ͼ��a��b�ǿɿ��Ƶĵ������У��������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С����
��ͼ��ʾ��û��ͨ������������Ʊ�����ʱ��Ƶ�װ�ã�ͼ��a��b�ǿɿ��Ƶĵ������У��������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С����


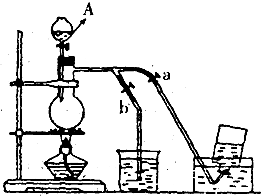
 ��ͼ��ʾ��û��ͨ������������Ʊ�����ʱ��Ƶ�װ�ã�ͼ��a��b�ǿɿ��Ƶĵ������У��������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С����
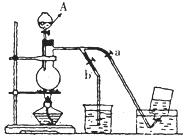
��ͼ��ʾ��û��ͨ������������Ʊ�����ʱ��Ƶ�װ�ã�ͼ��a��b�ǿɿ��Ƶĵ������У��������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С���� ��ͼ��ʾ��û��ͨ������������Ʊ�����ʱ��װ�ã�ͼ��a��b�ǿɿ��Ƶĵ������У�����֪�������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С��
��ͼ��ʾ��û��ͨ������������Ʊ�����ʱ��װ�ã�ͼ��a��b�ǿɿ��Ƶĵ������У�����֪�������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С��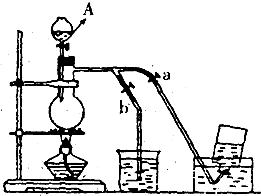 ��ͼ��ʾ��û��ͨ������������Ʊ�����ʱ��Ƶ�װ�ã�ͼ��a��b�ǿɿ��Ƶĵ������У��������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С����
��ͼ��ʾ��û��ͨ������������Ʊ�����ʱ��Ƶ�װ�ã�ͼ��a��b�ǿɿ��Ƶĵ������У��������ڱ����Ȼ�����Һ�е��ܽ�Ƚ�С����