
【题目】已知:25℃时,电离常数Kb(NH3·H2O)=1.8×l0-5,CH3COOH的电离常数与其相等。现向1 L 0.1 molL-1氨水中加入等体积的0.1 molL-1CH3COOH溶液,则下列说法正确的是
A. 在滴加过程中,Kw始终保持不变
B. 25℃时,反应后溶液中 c(NH4+)>c(CH3COO-)
C. 若用氨水标准溶液滴定盐酸,则应选择酚酞作为指示剂
D. 25℃时,反应NH4++H2O![]() NH3H2O+H+的平衡常数约为 5.6 ×10-10
NH3H2O+H+的平衡常数约为 5.6 ×10-10
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO等,工艺流程简化示意图如下:

根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是使_____________________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数∶氧原子数∶氢原子数=________。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式________________________。该反应的基本类型是_____________。
(4)“滤液3”之前加入锌粉的目的是__________________。
(5)“滤液3”之后的操作依次为________、干燥。
(6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于___________×100%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为地壳中含量最高的元素,则X在元素周期表中的位置是
A. 第一周期ⅠA族 B. 第二周期ⅣA族
C. 第二周期ⅥA族 D. 第三周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于同主族元素从上到下的下列说法不正确的是( )
A. 原子半径依次增大B. 金属性逐渐增强
C. 非金属性逐渐减弱D. 原子得电子能力逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢溶液可作为采矿业废液消毒剂,如消除采矿废液中剧毒的氰化钾,反应方程式为KCN+H2O2+H2O===A+NH3↑(已配平),请回答:(提示: ![]() 、
、![]() )
)
(1)生成物A的化学式是______________.
(2)该反应是否是氧化还原反应?________(填写“是”或“否”),其理由是_________________.若是,则被还原的元素是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯和甲苯的说法正确的是
A. 甲苯苯环上的一个氢原子被-C3H7取代得到的有机物结构共有3种
B. 等质量的苯和甲苯分别完全燃烧后,生成的CO2与消耗的O2的物质的量均相同
C. 苯的二溴代物有三种,则四溴代物有三种
D. 间二甲苯只有一种结构可说明苯分子中不存在碳碳单键与碳碳双键交替的结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,试管中集满了干燥的氯气,胶头滴管中装有供反应的足量浓氨水,滴入浓氨水,开始时试管内发生如下氧化还原反应:NH3+Cl2 →N2+HCl并产生红光和白烟,请根据以上反应现象回答下列问题:

(1)标志反应全部完成的现象是________________________。
(2)反应完成后,将试管浸入水中并倒立着试管,取下滴管,有水进入试管。在室温时,进入试管内的水约占试管容积的_________。
(3)反应中生成的白烟是:_____________________________。
(4)写出试管中反应的化学方程式:___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品:

(1)“酸浸”时加快反应速率的方法除了增加硫酸的浓度和加热外,还有___________________。(写出一种)
(2)在加NaOH调节溶液的pH时约为5,如果pH过大,可能导致滤渣1中 ___________________(填化学式)的含量减少。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8(过二硫酸氨)溶液,加热,Mn2+被氧化为MnO4-,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,平均消耗(NH4)2Fe(SO4)2标准溶液的体积为V mL。
①Mn2+与(NH4)2S2O8反应的离子方程式为___________________________________________。
②用含a、b、V的代数式表示“沉锰”前溶液中c(Mn2+)=_______________。
(4)①写出“沉锰”时的离子方程式:___________________________________________。
②在其他条件相同时,NH4HCO3的初始浓度越大,锰元素回收率越高,请从沉淀溶解平衡的角度解释其原因___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI===2KCl+I2。请回答下列问题:
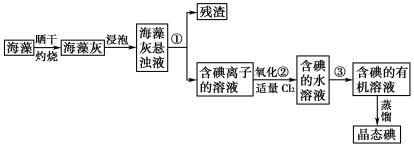
(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为紫红色溶液)。

(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①________________________________;
②________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com