
”¾ĢāÄæ”æ¼×“¼ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°”£ŌŚĢå»żæɱäµÄĆܱÕČŻĘ÷ÖŠĶ¶Čė0.5molCOŗĶ1molH2£¬²»Ķ¬Ģõ¼žĻĀ·¢Éś·“Ó¦£ŗCO(g)+2H2(g)![]() CH3OH(g)”£ŹµŃé²āµĆĘ½ŗāŹ±CH3OHµÄĪļÖŹµÄĮæĖęĪĀ¶Č”¢Ń¹ĒæµÄ±ä»ÆČēĶ¼1ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
CH3OH(g)”£ŹµŃé²āµĆĘ½ŗāŹ±CH3OHµÄĪļÖŹµÄĮæĖęĪĀ¶Č”¢Ń¹ĒæµÄ±ä»ÆČēĶ¼1ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
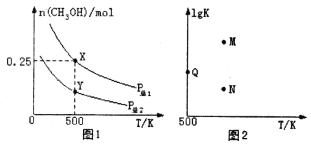
A.P×Ü1<P×Ü2
B.»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ·¢Éś±ä»Æ£¬ĖµĆ÷øĆ·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬
C.Ķ¼2ÖŠMµćÄÜÕżČ·±ķŹ¾øĆ·“Ó¦Ę½ŗā³£ŹżµÄ¶ŌŹż(1gK)ÓėĪĀ¶ČµÄ¹ŲĻµ
D.ČōP×Ü1=0.25MPa£¬ŌņYµćµÄĘ½ŗā³£ŹżKp=64(MPa)-2
”¾“š°ø”æBD
”¾½āĪö”æ
A£®¶ŌÓŚ·“Ó¦CO£Øg£©+2H2£Øg£©![]() CH3OH£Øg£©£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¼×“¼µÄĪļÖŹµÄĮæŌö“ó£»
CH3OH£Øg£©£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¼×“¼µÄĪļÖŹµÄĮæŌö“ó£»
B£®ČŻĘ÷Ģå»żæÉ±ä£¬Ę½ŗāŹ±£¬ČŻĘ÷Ģå»ż²»±ä£¬ĆÜ¶Č²»±ä£»
C£®ÉżøßĪĀ¶Č¼×“¼µÄĪļÖŹµÄĮæ¼õÉŁ£¬ĖµĆ÷ÉżøßĪĀ¶Č£¬Ę½ŗāÄęĻņŅĘ¶Æ£»
D£®X”¢YµćŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬ŌņĘ½ŗā³£ŹżĻąĶ¬£¬Xµć¼×“¼µÄĪļÖŹµÄĮæĪŖ0.25mol£¬æɼĘĖćĘ½ŗāŹ±ø÷ĪļÖŹµÄĮ棬½ų¶ų¼ĘĖć·ÖŃ¹£¬½įŗĻ·ÖŃ¹¼ĘĖćĘ½ŗā³£Źż”£
A£®¶ŌÓŚ·“Ó¦CO£Øg£©+2H2£Øg£©![]() CH3OH£Øg£©£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¼×“¼µÄĪļÖŹµÄĮæŌö“ó£¬ÓÉĶ¼ĻóæÉÖŖP×Ü1£¾P×Ü2£¬¹ŹA“ķĪó£»
CH3OH£Øg£©£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬¼×“¼µÄĪļÖŹµÄĮæŌö“ó£¬ÓÉĶ¼ĻóæÉÖŖP×Ü1£¾P×Ü2£¬¹ŹA“ķĪó£»
B£®ČŻĘ÷Ģå»żæɱ䣬“ļµ½Ę½ŗāŹ±£¬ČŻĘ÷Ģå»ż²»±ä£¬ÓÉÓŚĘųĢåµÄÖŹĮæ²»±ä£¬ŌņĆÜ¶Č²»±ä£¬æÉĖµĆ÷“ļµ½Ę½ŗāדĢ¬£¬¹ŹBÕżČ·£»
C£®ÉżøßĪĀ¶Č¼×“¼µÄĪļÖŹµÄĮæ¼õÉŁ£¬ĖµĆ÷ÉżøßĪĀ¶Č£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬ŌņÉżøßĪĀ¶Č£¬lgK¼õŠ”£¬NµćÄÜÕżČ·±ķŹ¾øĆ·“Ó¦Ę½ŗā³£ŹżµÄ¶ŌŹż£Ø1gK£©ÓėĪĀ¶ČµÄ¹ŲĻµ£¬¹ŹC“ķĪó£»
D£®X”¢YµćŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬ŌņĘ½ŗā³£ŹżĻąĶ¬£¬Xµć¼×“¼µÄĪļÖŹµÄĮæĪŖ0.25mol£¬Ōņ
ŌņK£ØY£©=K£ØX£©=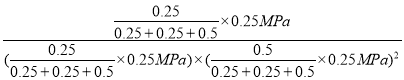 =64£ØMPa£©-2£¬¹ŹDÕżČ·”£
=64£ØMPa£©-2£¬¹ŹDÕżČ·”£
¹ŹŃ”£ŗBD”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓė½šŹōøÆŹ“ÓŠ¹ŲµÄĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
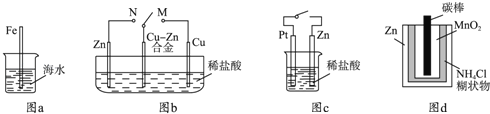
A.Ķ¼aÖŠ£¬²åČėŗ£Ė®ÖŠµÄĢś°ō£¬Ō½ææ½üµ×¶ĖøÆŹ“Ō½ŃĻÖŲ
B.Ķ¼bÖŠ£¬æŖ¹ŲÓÉMøÄÖĆÓŚNŹ±£¬Cu©ZnŗĻ½šµÄøÆŹ“ĖŁĀŹ¼õŠ”
C.Ķ¼cÖŠ£¬½ÓĶØæŖ¹ŲŹ±ZnøÆŹ“ĖŁĀŹŌö“ó£¬ZnÉĻ·Å³öĘųĢåµÄĖŁĀŹŅ²Ōö“ó
D.Ķ¼dÖŠ£¬Zn©MnO2øɵē³Ų×Ō·ÅµēøÆŹ“Ö÷ŅŖŹĒÓÉMnO2µÄŃõ»Æ×÷ÓĆŅżĘšµÄ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøßĆĢĖį¼ŲĻū¶¾Ę¬Ö÷ŅŖ³É·ÖĪŖKMnO4£¬æÉĶāÓĆĻūŃ×ɱ¾ś”£ÓĆijČķĆĢæó(Ö÷ŅŖ³É·ÖŹĒMnO2£¬»¹ŗ¬ÓŠA12O3”¢SiO2µČŌÓÖŹ)ÖʱøKMnO4µÄĮ÷³ĢĶ¼ČēĻĀ£ŗ

ŅŃÖŖ£ŗK2MnO4¹ĢĢåŗĶČÜŅŗ¾łĪŖÄ«ĀĢÉ«£¬ČÜŅŗ³Ź¼īŠŌĒŅÄÜ·¢ÉśæÉÄęµÄĘē»Æ·“Ó¦”£
(1)”°²Ł×÷I”±ÖŠ²£Į§°ōµÄ×÷ÓĆŹĒ____________”£”°²Ł×÷¢ņ”±Ź±£¬µ±__________Ź±£¬Ķ£Ö¹¼ÓČČ£¬×ŌČ»ĄäČ“£¬³éĀĖŗó¼“æÉ»ńµĆ×ĻŗŚÉ«KMnO4¾§Ģ唣
(2)Ļņ”°½žČ”Ņŗ”±ÖŠĶØČėCO2£¬µ÷½ŚĘäpH£¬¾”°¹żĀĖ”±µĆĀĖŌüI£¬ĀĖŌüIµÄ³É·ÖĪŖ__________”£
(3)”°ČŪČŚģŃÉÕ”±Ź±£¬MnO2²ĪÓė·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_________________________”£
(4)”°Ęē»Æ”±Ź±£¬¼ÓČė±ł“×ĖįµÄÄæµÄŹĒ___________________________(ÓƱŲŅŖµÄĄė×Ó·½³ĢŹ½ŗĶĪÄ×Ö½āŹĶ)”£
(5)”°Ęē»Æ”±Ź±£¬ĻĀĮŠĖįæÉŅŌÓĆĄ““śĢ걳“×ĖįµÄŹĒ___________(Ģī×ÖÄø)”£
a£®ÅØŃĪĖį b£®ŃĒĮņĖį c£®Ļ”ĮņĖį d£®ĒāµāĖį
(6)ÖĘČ”¹ż³ĢÖŠ£¬ČōpHµ÷½Ś²»ŗĻĄķŅ×Éś³ÉMn2+”£ŌŚ·ĻĖ®“¦ĄķĮģÓņÖŠ³£ÓĆH2S½«Mn2+×Ŗ»ÆĪŖMnS³żČ„£¬Ļņŗ¬0.05mol”¤L-1Mn2+·ĻĖ®ÖŠĶØČėŅ»¶ØĮæH2SĘųĢ壬µ÷½ŚČÜŅŗµÄpH=a£¬µ±HS-ÅضČĪŖ1.0”Į10-4mol”¤L-1Ź±£¬Mn2+æŖŹ¼³Įµķ£¬Ōņa=__________”£[ŅŃÖŖ£ŗH2SµÄKa1=1.3”Į10-7 Ka2=5.0”Į10-15£»Ksp(MnS)=2.5”Į10-14]
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫ÅØ¶Č¾łĪŖ0.5mol”¤L-1µÄ°±Ė®ŗĶKOHČÜŅŗ·Ö±šµĪČėµ½Į½·Ż¾łĪŖ20mLc1mol”¤L-1µÄAlCl3ČÜŅŗÖŠ£¬²āµĆČÜŅŗµÄµ¼µēĀŹÓė¼ÓČė¼īµÄĢå»ż¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A.c1=0.2
B.bµćŹ±ČÜŅŗµÄĄė×ÓÅØ¶Č£ŗc(C1-)>c(NH4+)>c(OH-)>c(H+)
C.ac¶Ī·¢ÉśµÄ·“Ó¦ĪŖ£ŗA1(OH)3+OH-==[Al(OH)4]-
D.dµćŹ±ČÜŅŗÖŠ£ŗc(K+)+c(H+)==[Al(OH)4]-+c(OH-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµē½āŗĻ³É1£¬2£¶žĀČŅŅĶéµÄŹµŃé×°ÖĆČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø £©
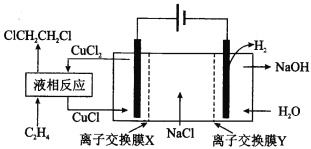
A.øĆ×°ÖĆ¹¤×÷Ź±£¬Ņõ¼«ĒųČÜŅŗÖŠµÄĄė×ÓÅØ¶Č²»¶ĻŌö“ó
B.ŅŗĻą·“Ó¦ÖŠ£¬C2H4±»CuCl2Ńõ»ÆĪŖ1£¬2£¶žĀČŅŅĶé
C.X”¢YŅĄ“ĪĪŖŃōĄė×Ó½»»»Ä¤”¢ŅõĄė×Ó½»»»Ä¤
D.øĆ×°ÖĆ×Ü·“Ó¦ĪŖCH2=CH2+2H2O+2NaCl![]() H2”ü+2NaOH+ClCH2CH2Cl
H2ӟ+2NaOH+ClCH2CH2Cl
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ½üÄźĄ“ĪŅ¹śæĘѧ¼Ņ·¢ĻÖĮĖŅ»ĻµĮŠŅāŅåÖŲ“óµÄĢśĻµ³¬µ¼²ÄĮĻ£¬ĘäÖŠŅ»ĄąĪŖFeSmAsFO×é³ÉµÄ»ÆŗĻĪļ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŖĖŲAsÓėNĶ¬×唣Ō¤²āAsµÄĒā»ÆĪļ·Ö×ÓµÄĮ¢Ģå½į¹¹ĪŖ_______£¬Ęä·Šµć±ČNH3µÄ_______£ØĢī”°øß”±»ņ”°µĶ”±£©£¬ĘäÅŠ¶ĻĄķÓÉŹĒ_________________________”£
£Ø2£©Fe³ÉĪŖŃōĄė×ÓŹ±Ź×ĻČŹ§Č„______¹ģµĄµē×Ó£¬SmµÄ¼Ū²ćµē×ÓÅŲ¼Ź½ĪŖ4f66s2£¬Sm3+µÄ¼Ū²ćµē×ÓÅŲ¼Ź½ĪŖ______________________”£
£Ø3£©±Č½ĻĄė×Ó°ė¾¶£ŗF__________O2£ØĢī”°“óÓŚ”±µČÓŚ”±»ņ”°Š”ÓŚ”±£©”£
£Ø4£©Ņ»ÖÖĖÄ·½½į¹¹µÄ³¬µ¼»ÆŗĻĪļµÄ¾§°ū½į¹¹ČēĶ¼1ĖłŹ¾£¬¾§°ūÖŠSmŗĶAsŌ×ÓµÄĶ¶Ó°Ī»ÖĆČēĶ¼2ĖłŹ¾”£

Ķ¼ÖŠFŗĶO2¹²Ķ¬Õ¼¾Ż¾§°ūµÄÉĻĻĀµ×ĆęĪ»ÖĆ£¬ČōĮ½ÕߵıȥżŅĄ“ĪÓĆxŗĶ1x“ś±ķ£¬ŌņøĆ»ÆŗĻĪļµÄ»ÆѧŹ½±ķŹ¾ĪŖ____________£¬Ķعż²ā¶ØĆܶȦŃŗĶ¾§°ū²ĪŹż£¬æÉŅŌ¼ĘĖćøĆĪļÖŹµÄxÖµ£¬Ķź³ÉĖüĆĒ¹ŲĻµ±ķ“ļŹ½£ŗ¦Ń=________g”¤cm3”£
ŅŌ¾§°ū²ĪŹżĪŖµ„Ī»³¤¶Č½ØĮ¢µÄ×ų±źĻµæÉŅŌ±ķŹ¾¾§°ūÖŠø÷Ō×ÓµÄĪ»ÖĆ£¬³Ę×÷Ō×Ó·ÖŹż×ų±ź£¬ĄżČēĶ¼1ÖŠŌ×Ó1µÄ×ų±źĪŖ(![]() )£¬ŌņŌ×Ó2ŗĶ3µÄ×ų±ź·Ö±šĪŖ__________”¢__________”£
)£¬ŌņŌ×Ó2ŗĶ3µÄ×ų±ź·Ö±šĪŖ__________”¢__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ»śĪļJŹōÓŚ“óĪ»×čĆŃĻµĮŠÖŠµÄŅ»ÖÖĪļÖŹ,ŌŚÓŠ»ś»Æ¹¤ĮģÓņ¾ßÓŠŹ®·ÖÖŲŅŖµÄ¼ŪÖµ.2018ÄźĪŅ¹śŹ×“ĪŹ¹ÓƦĮ£äå“śōŹ»ł»ÆŗĻĪļŗĻ³É“óĪ»×čĆŃJ,ĘäŗĻ³ÉĀ·ĻßČēĻĀ:

ŅŃÖŖ£ŗ
»Ų“šĻĀĮŠĪŹĢā:
(1)A µÄĆū³Ę___________________.
(2)C ”śDµÄ»Æѧ·½³ĢŹ½_________________________.E ”śFµÄ·“Ó¦ĄąŠĶ____
(3)H ÖŠŗ¬ÓŠµÄ¹ŁÄÜĶÅ________________.JµÄ·Ö×ÓŹ½_______________.
(4)»ÆŗĻĪļXŹĒDµÄĶ¬·ÖŅģ¹¹Ģå,ĘäÖŠÄÜÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄXÓŠ_____________ÖÖ(²»æ¼ĀĒĮ¢ĢåŅģ¹¹),Š“³öĘäÖŠŗĖ“Ź²ÕńĒāĘ×ÓŠ3×é·å,·åĆ껿֮±ČĪŖ1”Ć1”Ć6µÄ½į¹¹¼ņŹ½ĪŖ___________________________.
(5)²ĪÕÕĢāÖŠŗĻ³ÉĀ·ĻßĶ¼”£Éę¼°ŅŌ¼×±½ŗĶ ĪŖŌĮĻĄ“ŗĻ³ÉĮķŅ»ÖÖ“óĪ»×čĆŃ
ĪŖŌĮĻĄ“ŗĻ³ÉĮķŅ»ÖÖ“óĪ»×čĆŃ µÄŗĻ³ÉĀ·Ļߣŗ__________________”£
µÄŗĻ³ÉĀ·Ļߣŗ__________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫¢ŁH+”¢¢ŚCl£”¢¢ŪAl3£«”¢¢ÜK£«”¢¢ŻS2£”¢¢ŽOH£”¢¢ßNO3£”¢¢ąNH4£«·Ö±š¼ÓČėH2OÖŠ£¬»ł±¾ÉĻ²»Ó°ĻģĖ®µÄµēĄėĘ½ŗāµÄĄė×ÓŹĒ£Ø £©
A.¢Ł¢Ū¢Ż¢ß¢ąB.¢Ś¢Ü¢Ž¢ąC.¢Ł¢ŽD.¢Ś¢Ü¢ß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĻĀĆęµÄ·“Ó¦Ā·Ļß¼°ĖłøųŠÅĻ¢ĢīæÕ”£
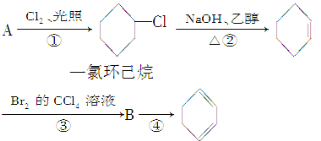
£Ø1£©AµÄ½į¹¹¼ņŹ½ŹĒ______£¬Ćū³ĘŹĒ______”£
£Ø2£©¢ŁµÄ·“Ó¦ĄąŠĶŹĒ______£¬¢ŚµÄ·“Ó¦ĄąŠĶŹĒ______”£
£Ø3£©·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½ŹĒ__________________________________
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com