
| A. | 摩尔表示物质的质量的单位 | B. | 16gO2含有0.5mol O2分子 | ||
| C. | 2gH2的体积约为22.4L | D. | 物质的摩尔质量等于其式量 |
分析 A.物质的量为基本物理量之一,单位为摩尔;
B.结合m=nM计算;
C.结合V=nVm计算;
D.摩尔质量单位为g/mol,式量的单位为1.
解答 解:A.物质的量为基本物理量之一,单位为摩尔,符合为mol,而质量的单位为g,故A错误;
B.16gO2的物质的量为$\frac{16g}{32g/mol}$=0.5mol,则有0.5mol O2分子,故B正确;
C.由V=nVm可计算气体的体积,但状况未知,Vm不确定,不能计算,故C错误;
D.摩尔质量单位为g/mol,式量的单位为1,对同种物质来说二者的数值相同,故D错误;
故选B.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成及基本计算公式的应用,选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用“84消毒液”进行消毒 | |
| B. | 用浓硫酸干燥二氧化硫气体 | |
| C. | 用活性炭吸附新装修居室里的有害气体 | |
| D. | 用小苏打治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
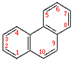 .它的一氯代物有5种.
.它的一氯代物有5种. ,试再写出另一种的结构简式
,试再写出另一种的结构简式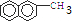 .
.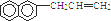 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡比氢氧化钙的碱性强 | |
| B. | HBrO4的酸性比HIO4强 | |
| C. | 铍(Be)原子失电子的能力比镁弱 | |
| D. | 硒(Se)化氢的稳定性比硫化氢的稳定性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥ | B. | ②④⑤⑥ | C. | ⑤⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
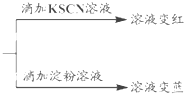
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
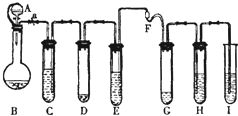 “化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌游戏一样.如图是一个“化学多米诺实验”.各装置中试剂或物质:
“化学多米诺实验”即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需控制第一个反应,就好像多米诺骨牌游戏一样.如图是一个“化学多米诺实验”.各装置中试剂或物质:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com