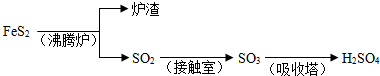
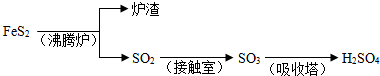
(1)40gSO
3气体物质的量为0.5mol,生成液态硫酸放出65.15kJ,
则1molSO
3气体被水完全吸收生成液态硫酸放出130.3kJ热量,
热化学方程式为:SO
3(g)+H
2O(l)=H
2SO
4(l)△H=-130.3kJ/mol,
故答案为:SO
3(g)+H
2O(l)=H
2SO
4(l)△H=-130.3kJ/mol;
(2)①化学平衡常数的大小可以表示反应进行的程度.化学平衡常数只与温度有关,吸热反应平衡常数随温度升高而增大,放热反应则相反.根据表中数据可知:随温度升高平衡常数减小,说明正反应为放热反应,放热反应△H<0,
故SO
2(g)+
O
2(g)
SO
3(g)△H=a kJ?mol
-1 反应中a<0,为负值.
故答案为:<;
②A.化学平衡常数的大小可以表示反应进行的程度.K值越大,表明反应进行的程度越大,而反应进行的程度越大,并不意味SO
2的转化率一定越高,故A不正确;
B.K值越大,表明反应进行的程度越大,而反应进行的程度越大,并不意味SO
3的产量一定越大,产量还取决与反应物的投料量等因素.故B不正确;
C.化学平衡常数的大小可以表示反应进行的程度.K值越大,表明反应进行的程度越大,正反应进行得越完全.故C正确;
D.化学平衡常数的大小可以表示反应进行的程度.不表示反应的快慢,与化学反应速率无关.故D不正确;
故答案为:C;
(3)A.Fe
2O
3 与CO反应需要高温,消耗大量能量,然后Fe与浓硫酸反应时有二氧化硫放出,污染环境,不符合绿色化学理念.故A不正确;
B.Fe
2O
3 +3H
2SO
4 ═Fe
2(SO
4)
3 +3H
2O,Fe
2(SO
4)
3 +Fe═3FeSO
4,反应中无污染物产生,最能体现绿色化学理念的方案.故B正确;
C.Fe与浓硫酸反应时有二氧化硫放出,污染环境,不符合绿色化学理念.故C不正确;
故答案为:B;
(4)
| 实验序号 |
催化剂颗粒大小 |
温度(K) |
压强(KPa) |
| 1 |
粗颗粒 |
673 |
101Kpa增大到1010Kpa |
| 2 |
细颗粒 |
673 |
101Kpa增大到1010Kpa |
| 3 |
粗颗粒 |
673K增大到723K |
101Kpa |
| 4 |
细颗粒 |
673K增大到723K |
101Kpa |
第一组和第二组保持温度不变,逐步增大压强,对比催化剂粗颗粒与细颗粒对反应速率的影响,
第三组和第四组保持压强不变,逐步升高温度,对比催化剂粗颗粒与细颗粒对反应速率的影响,
所以通过变换这些实验条件,至少需要完成4个实验然后进行对比才能得出结论,
故答案为:4;
(5)设可制得石膏物质的量为x,
22.4m
3(标准状况下)的尾气物质的量为:
=1000mol,
尾气中SO
2的体积分数为0.200%,得SO
2物质的量为:1000mol×0.200%=2mol,二氧化硫的利用率为80.0%,
反应方程式为:CaCO
3+SO
2+H
2O═CaSO
3+CO
2↑+H
2O、2CaSO
3+O
2+4H
2O═2CaSO
4?2H
2O,
根据硫元素守恒得:SO
2 ~CaSO
4?2H
2O
1mol 1mol
2mol×80.0% x
解得:x=1.6mol,
则石膏的质量为:1.6mol×172g/mol=275.2g≈0.28Kg,
故答案为:0.28;
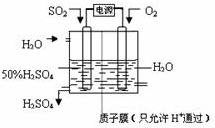
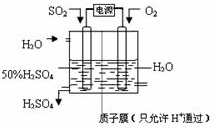
(6)电解池中阳极是还原剂发生氧化反应,阴极是氧化剂发生还原反应.根据题意可知:通入二氧化硫的电极为阳极,通入氧气的电极为阴极,阳极反应:SO
2+2H
2O-2e
-=SO
42-+4H
+,阴极反应:O
2+4H
++4e
-═2H
2O,阴、阳电极反应合并得总反应为:2SO
2+O
2+2H
2O=2H
2SO
4.
故答案为:SO
2+2H
2O-2e
-=SO
42-+4H
+、2SO
2+O
2+2H
2O=2H
2SO
4.



 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案

 O2(g)
O2(g) SO3(g)△H=a kJ?mol-1 下表为不同温度(T)下该反应的化学平衡常数(K):
SO3(g)△H=a kJ?mol-1 下表为不同温度(T)下该反应的化学平衡常数(K): Fe
Fe FeSO4
FeSO4 Fe2(SO4)3
Fe2(SO4)3 FeSO
FeSO 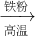 Fe
Fe FeSO4
FeSO4 Fe
Fe FeSO4
FeSO4
 O2(g)
O2(g)  SO3(g)△H=a kJ?mol-1
SO3(g)△H=a kJ?mol-1 Fe
Fe FeSO4;B.Fe2O3
FeSO4;B.Fe2O3 Fe2(SO4)3
Fe2(SO4)3 FeSO4;C.Fe2O3
FeSO4;C.Fe2O3 Fe
Fe FeSO4
FeSO4