
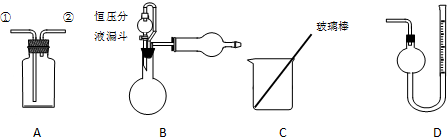
分析 (1)Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,根据反应方程式即可算出Zn的质量分数;往D中注入一定量的水,记录液面所在的位置,一段时间后液面位置保持不变,说明气密性良好;
(2)计算生成氢气的物质的量,根据电子守恒计算Zn的质量,进而计算Zn的质量分数;
(3)可以获得Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积可求出Zn的厚度;
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,加入氢氧化钠溶液排出空气体积会计算在生成氢气的体积之内;
(5)选用仪器C做实验,试样经充分反应,经过过滤、洗涤、烘干,称得其质量为m2g,利用锌反应铁不反应计算;
(6)利用锌反应铁不反应,固体减少的质量即为Zn的质量.
解答 解:(1)Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,根据反应方程式即可算出Zn的质量分数,所以需要的装置有测H2的体积的D装置;往D中注入一定量的水,记录液面所在的位置,一段时间后液面位置保持不变,说明气密性良好;
故答案为:D;往D中注入一定量的水,记录液面所在的位置,一段时间后液面位置保持不变,说明气密性良好
(2)根据电子转移守恒,可知n(Zn)=n(H2)=$\frac{VL}{22.4L/mol}$=$\frac{V}{22.4}$mol,则w (Zn)=$\frac{\frac{V}{22.4}×65}{m{\;}_{1}}$=$\frac{65V}{22.4m{\;}_{1}}$,
故答案为:$\frac{65V}{22.4m{\;}_{1}}$;
(3)有可以获得Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积可求出Zn的厚度,
故答案为:金属锌的密度;
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,加入氢氧化钠溶液排出空气体积会计算在生成氢气的体积之内,导致氢气体积偏大,计算Zn的质量分数偏大,故答案为:偏大;
(5)选用仪器C做实验,试样经充分反应,经过过滤、洗涤、烘干,称得其质量为m2g,利用锌反应铁不反应原理计算,故答案为:过滤、洗涤、烘干;
(6)减少的质量即为Zn的质量,减少的质量为m1g-m2g,故ω(Zn)=$\frac{m{\;}_{1}-m{\;}_{2}}{m{\;}_{1}}$,故答案为:$\frac{m{\;}_{1}-m{\;}_{2}}{m{\;}_{1}}$.
点评 本题考查物质含量测定,关键是测定原理的理解,侧重考查学生分析问题、设计实验的能力,注意定量实验中尽可能的减少误差.


科目:高中化学 来源: 题型:选择题
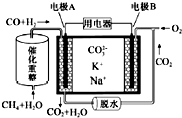
| A. | 电极B为正极,CO2在正极发生还原反应 | |
| B. | 电极A上H2参与的电极反应为:H2+CO32--2e-=CO2↑+H2O | |
| C. | 电极B上发生的电极反应为:4H++O2+4e-=2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s电子云呈球形,表示电子绕原子核做圆周运动 | |
| B. | 电子云图中的小黑点密度大,说明该原子核外空间电子数目多 | |
| C. | 光谱分析可用于鉴定元素 | |
| D. | 3d3表示3d能级有3个轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
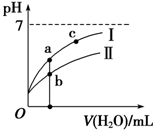 已知:25℃时某些弱酸的电离平衡常数.下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数.下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10 -5 | Ka=3.0×10 -8 | Ka1=4.1×10 -7 Ka2=5.6×10 -11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通少量CO2的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c(R-)}{c(HR)•c(OH-)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度等于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子里含有碳碳三键的脂肪烃 | |
| B. | 易发生加成反应 | |
| C. | 既能使溴水褪色也能使酸性高锰酸钾溶液褪色 | |
| D. | 分子里所有的碳原子都处在同一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
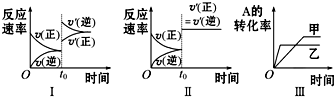
| A. | 图Ⅰ可体现t0时升高温度对反应速率的影响 | |
| B. | 图Ⅱ可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 | |
| C. | 图Ⅲ可体现催化剂对化学平衡的影响,且甲使用了催化剂 | |
| D. | 图Ⅲ可体现温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱属于碱 | B. | 小苏打不属于电解质 | ||
| C. | 水玻璃属于纯净物 | D. | CO不属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{30MP}^{500℃}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ•mol-1 | |
| D. | 25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ•mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com