
下列有关平衡常数(K、Ka、Kw、Ksp)的说法中错误的是
| A.若各平衡常数(K、Ka、Kw、Ksp)的值发生变化,则平衡一定发生移动 |
| B.若温度升高,则各平衡常数一定增大 |
| C.平衡常数的大小能说明反应(或电离、溶解)进行的程度 |
| D.某一可逆反应的平衡常数越大,表明反应(或电离、溶解)进行的程度越大 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中正确的是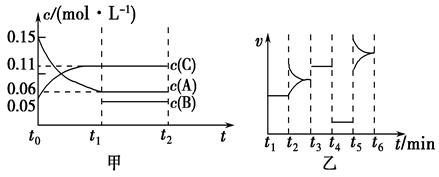
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.该容器的容积为2 L,B的起始物质的量为0.02 mol
C.t4~t5阶段改变的条件一定为减小压强
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:3A(g) B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下反应N2+O2 2NO在密闭容器中进行,下列措施不改变化学反应速率的是
2NO在密闭容器中进行,下列措施不改变化学反应速率的是
| A.缩小体积使压强增大 | B.恒容,充入N2 |
| C.恒容,充入He | D.恒压,充入He |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
| A.加入适量的6 mol·L-1的盐酸 | B.加入数滴氯化铜溶液 |
| C.加入适量蒸馏水 | D.加入适量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于平衡常数,下列说法不正确的是
| A.平衡常数随温度的改变而改变 |
| B.使用催化剂不能改变平衡常数 |
| C.平衡常数不随反应物或生成物浓度的改变而改变 |
| D.增大压强促使平衡向正反应方向进行,则平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可逆反应2SO2(g) +O2(g) 2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
2SO3(g)在不同条件下的反应速率如下,其中反应速率最快的是 ( )
| A.υ(SO2)=0.5mol/(L?s) | B.υ(O2)=1mol/(L?min) |
| C.υ(SO3)=0.6mol/(L?s) | D.υ(O2)=0.4mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
2 HBr(g) ΔH<0平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
| A.a>b | B.a=b | C.a<b | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将2.0molPCl3,和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
| A.0.40mol | B.小于0.20mol | C.0.20mol | D.大于0.20mol,小于0.40mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com