
| A. | 锌与镁 | B. | 铁与锌 | C. | 铝与铁 | D. | 镁与铁 |
分析 假设金属都为+2价,根据电子转移守恒计算金属物质的量,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算金属混合物的平衡相对原子质量,平均相对原子质量应介于各组分之间,若金属不与盐酸反应,可以视作其相对原子质量为无穷大;Al为+2价的幸福在这里为:$\frac{27}{3}$×2=18,据此进行解答.
解答 解:标准状况下,11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均相对原子质量为:$\frac{11.5}{0.5}$=23,
A.Zn的相对原子质量为65,Mg的相对原子质量为24,均大于23,故A错误;
B.Fe的相对原子质量为56,Zn的相对原子质量为65,均大于23,故B错误;
C.Fe的相对原子质量为56,当Al的化合价为+2价时,可看成其相对原子质量为$\frac{2}{3}$×27=18,金属混合物的平均相对原子质量为23,介于二者之间,故B正确;
D.Mg的相对原子质量为24,Fe的相对原子质量为56,二者平均相对原子质量介于24~56之间,大于23,故D错误;
故选C.
点评 本题考查混合物反应的计算,题目难度中等,利用平均值法即可快速解答,注意Al的化合价与相对原子质量的转化,试题培养了学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
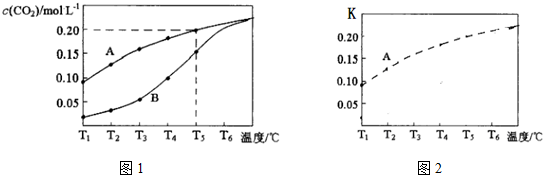
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
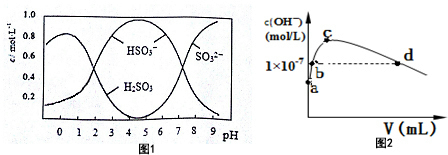 (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-14 | Ki=4.9×10-14 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 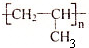 | B. |  | C. | 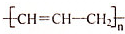 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果盐酸的浓度是醋酸的两倍,则盐酸中的H+浓度也是醋酸中的两倍 | |
| B. | 将NaOH溶液和氨水各稀释一份,两者的OH-浓度均减小到原来的$\frac{1}{2}$ | |
| C. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| D. | 若电解质溶液的导电能力也可能比强电解质溶液的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com