
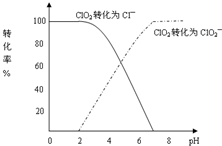
 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg?L-1.饮用水中CIO2、CIO2-的含量可用连续碘量法进行测定.CIO2被I-还原为CIO2-、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO2-也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:| cV1 |
| 1000 |
| cV1 |
| 1000 |
| cV2 |
| 1000 |
| 1 |
| 4 |
| cV2 |
| 1000 |
| c(V2-4V1) |
| 4V |
| c(V2-4V1) |
| 4V |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 在KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
查看答案和解析>>
科目:高中化学 来源: 题型:
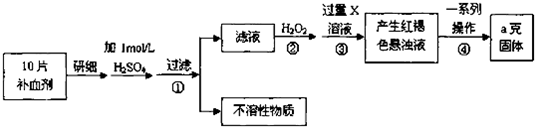
查看答案和解析>>
科目:高中化学 来源: 题型:
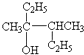
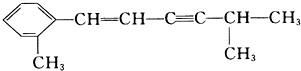 该分子中最多有
该分子中最多有 ,这三种单体的结构简式分别是
,这三种单体的结构简式分别是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
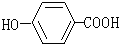
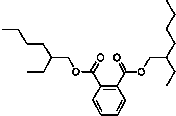 受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )
受台湾“塑化剂污染食品”风波的影响,2011年6月1日卫生部紧急发布公告,将塑化剂列入食品中可能违法添加的非食用物质和易滥用的食品添加剂名单.已知塑化剂DEHP分子结构简式如图.下列说法中不正确的是( )| A、DEHP是芳香族化合物 |
| B、DEHP是酯类物质 |
| C、DEHP分子中共有5个双键 |
| D、DEHP分子中至少有8个碳原子在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,正向反应速率增加,逆向反应速率减小 |
| B、升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C、达到平衡后,升高温度有利于该反应平衡正向移动 |
| D、达到平衡后,减小压强有利于该反应平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com