
| ||
| 1000ρw |
| M |
| ||
| 1000×1.19×36.5% |
| 36.5 |
| ||
| 5.6L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
A、二氧化碳的电子式: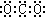 |
| B、水分子的结构式:H-O-H |
C、乙烯的比例模型: |
| D、碳酸氢钠溶于水的电离方程式:NaHCO3=Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.25 mol |
| B、0.35 mol |
| C、0.50mol |
| D、0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
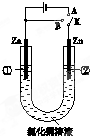 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按图连接.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO?N2+2CO2△H<0
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为2CO+2NO?N2+2CO2△H<0查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B、CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol |
| C、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com