
下列各组物质中,可以用分液漏斗分离的一组是
A.酒精和碘 B.苯和水 C.乙酸和水 D.溴和四氯化碳
科目:高中化学 来源:2013-2014北京市通州区高考二模理综化学试卷(解析版) 题型:填空题
(14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知:
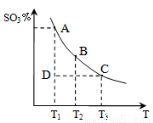
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO 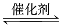 2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。

①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为 L/min(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高二年级期末考试化学试卷(解析版) 题型:选择题
下列有机物中,不属于羧酸的是
A. 乙二酸 B. 苯甲酸 C. 石炭酸 D. 硬脂酸
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高一年级期末考试化学试卷(解析版) 题型:选择题
下列实验结论不正确的是
| 实验操作 | 现象 | 结论 |
A | 食醋浸泡水垢 | 产生无色气体 | 乙酸的酸性比碳酸强 |
B | 乙醇与橙色酸性重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
C | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
D | 新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀 | 葡萄糖具有还原性 |
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市西城区下学期高一年级期末考试化学试卷(解析版) 题型:选择题
下列反应最能体现“原子经济”的是
A.甲烷与氯气制备一氯甲烷 B.乙烯聚合为聚乙烯高分子材料
C.以铜和浓硝酸为原料生产硝酸铜 D.用苯和浓硝酸反应制取硝基苯
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市海淀区高三第二学期二模理综化学试卷(解析版) 题型:简答题
(14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
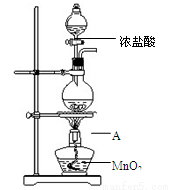
(1)仪器A的名称为 ;A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 |
|
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为 。
②不能证明产生的气体中含有HCl的实验是 (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因: 。
(4)已知:2S2O32- + I2 === S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol?L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol?L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是 。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于 mL(用含V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市朝阳区高三二模理综化学试卷(解析版) 题型:选择题
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
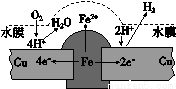
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H+ + 2e- == H2↑,O2 + 4e- + 4H+ == 2H2O
D. 在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(重庆卷解析版) 题型:填空题
(15分)月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为_____________。
(2)Na的原子结构示意图为______,Na在氧气中完全燃烧所得产物的电子式为_______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为______;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为______(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg3He同时可得6000kgH2和700kgN2,若以所得H2和N2为原料经一系列反应最多可制得碳酸氢铵___kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com