
| A. | 0.1 mol•L-1 CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合 | |
| B. | 向40mL0.2 mol•L-1的NaOH溶液中通入67.2mLCO2(标况) | |
| C. | 在100mL1 mol•L-1NH4Cl溶液中,投入3.9gNa2O2 | |
| D. | 在20mL0.01 mol•L-1Ma(HCO3)2溶液中,投入0.2g Ma(OH)2 |
分析 A.醋酸与氢氧化钠恰好反应,溶液蒸干得到醋酸钠;
B.NaOH的物质的量=0.04L×0.2mol/L=0.008mol,67.2mL二氧化碳的物质的量=$\frac{0.0672L}{22.4L/mol}$=0.003mol,二者物质的量之比大于2:1,故发生反应2NaOH+CO2=Na2CO3+H2O,且NaOH有剩余;
C.3.9克Na2O2的物质的量=$\frac{3.9g}{78g/mol}$=0.05mol,发生反应2Na2O2+2H2O=4NaOH+O2↑,生成NaOH为 0.1mol,NH4Cl的物质的量=0.1L×1mol/L=0.1mol,由NaOH+NH4Cl=NaCl+NH3.H2O可知,氢氧化钠与氯化铵恰好反应,蒸干氨气挥发;
D.加热蒸干,充分灼烧,碳酸氢镁、氢氧化镁都分解,最终得到氧化镁.
解答 解:A.醋酸与氢氧化钠的物质的量相等,则醋酸与氢氧化钠恰好反应,溶液蒸干得到醋酸钠,故A不符合;
B.NaOH的物质的量=0.04L×0.2mol/L=0.008mol,67.2mL二氧化碳的物质的量=$\frac{0.0672L}{22.4L/mol}$=0.003mol,二者物质的量之比大于2:1,故发生反应2NaOH+CO2=Na2CO3+H2O,且NaOH有剩余,蒸干后灼烧,所得固体为碳酸钠、氢氧化钠混合物,故B符合;
C.3.9克Na2O2的物质的量=$\frac{3.9g}{78g/mol}$=0.05mol,发生反应2Na2O2+2H2O=4NaOH+O2↑,生成NaOH为0.1mol,NH4Cl的物质的量=0.1L×1mol/L=0.1mol,由NaOH+NH4Cl=NaCl+NH3.H2O可知,氢氧化钠与氯化铵恰好反应,蒸干氨气挥发,最终得到NaCl,故C不符合;
D.加热蒸干,充分灼烧,碳酸氢镁分解为氧化镁、二氧化碳与水,氢氧化镁都分解氧化镁与水,最终得到氧化镁,故D不符合,
故选B.
点评 本题考查元素化合物性质、根据方程式的计算等,关键明确发生的反应进行过量计算,难度不大.


 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:选择题
| A. | 少量浓硫酸溅到皮肤上,立即用氢氧化钠溶液冲洗 | |
| B. | 当出现CO中毒时,应立即将中毒者抬到室外空气新鲜处 | |
| C. | 将含硫酸的废液倒入水槽,用水冲入下水道 | |
| D. | 制取并收集氧气结束后,应立即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
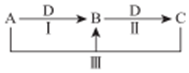 A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D 都是中学化学中常见物质,其中 A、B、C 均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNacl 固体中含有NA个Na+ | |
| B. | 18gD2O和18gH2 O中含有的质子数均为10NA | |
| C. | 标准状况下2.24LH2O 含有的共价键数为0.2NA | |
| D. | 密闭容答中2molNO 与lmolO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性强弱为:X>Y>Z | |
| B. | 气态氢化物的稳定性由强到弱为X、Y、Z | |
| C. | 原子半径大小是:X<Y<Z | |
| D. | 对应阴离子的还原性按X、Y、Z顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只测定它的C、H比 | |
| B. | 只需证明它完全燃烧后产物只有H2O和CO2 | |
| C. | 只测定其燃烧产物中H2O与CO2的物质的量的比值 | |
| D. | 测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com