
分析 电解饱和食盐水发生的反应为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,和电极反应,结合电解过程中电子守恒计算,化学方程式的计算;
解答 解:(1)电解饱和食盐水发生的反应为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
若电解饱和食盐水时消耗NaCl 117g,反应的氯化钠物质的量=$\frac{117g}{58.5g/mol}$=2mol;依据化学方程式计算得到:氯气物质的量为1mol,标准状况下氯气体积为22,4L;而生成1mol的氯气转移电子的物质的量2mol,
答:理论上最多可得到22.4L体积的氯气,转移的电子为2mol;
(2)若将2mol氯气通入足量石灰乳中发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;2molCl2完全反应生成次氯酸钙物质的量为1mol,则次氯酸钙质量=1mol×143g/mol=143g;
答:理论上可得次氯酸钙143g.
点评 本题考查了电解食盐水的原理应用,氯气性质的应用,化学方程式的计算方法,质量和物质的量的换算计算,气体摩尔体积的换算应用,题目简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、Al3+、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
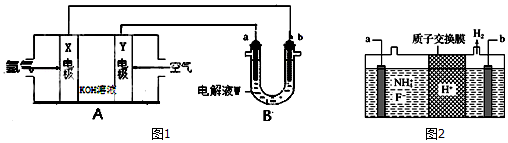
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | NaOH | C. | Na2CO3 | D. | AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
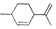 的化合物,则下列有关它的推断错误的是( )
的化合物,则下列有关它的推断错误的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有9种 | ||
| C. | 常温下呈固态,比水重 | D. | 能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
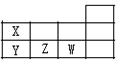
| A. | 原子半径:Y>Z>W | B. | 酸性:HWO4>HXO3>H3YO4 | ||
| C. | 热稳定性:HW>XH3>YH3 | D. | 离子半径:Y3-<Z2-<W- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
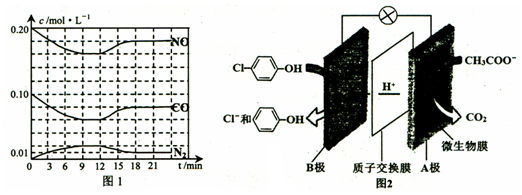
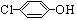 )的酸性废水;可利用微生物电池法除去,其原理如图2所示.
)的酸性废水;可利用微生物电池法除去,其原理如图2所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com