
【题目】已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸溶液的KW=1.0×10-14 mol2·L2-
D. 若HB+NaA=HA+NaB能进行,则Ka(HB)>Ka(HA)
 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A. 氢氧化钠与盐酸;氢氧化钠与醋酸
B. Na2CO3溶液与盐酸;CaCO3与盐酸
C. BaCl2溶液与Na2SO4溶液;BaCl2溶液与NaHSO4溶液
D. Fe(OH)3胶体的制备;Fe(OH)3沉淀的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氯水与久置的氯水相比较,下列结论不正确的是
A. 颜色相同 B. 前者能使有色布条褪色
C. 都含有H+ D. 加AgNO3溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=a的某电解质溶液中,插入两支惰性电极,通直流电一段时间后,溶液的pH>a,则该电解质可能是
A. Na2SO4 B. H2SO4 C. AgNO3 D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用98%的浓硫酸,密度为1.84g/cm3的浓H2SO4来配制500mL0.2mol/L的稀H2SO4,需浓硫酸 _____________ mL;将该稀硫酸与适量的铁屑充分反应,计算:生成的H2的体积(标况)为_________(注意写详细解题步骤)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:
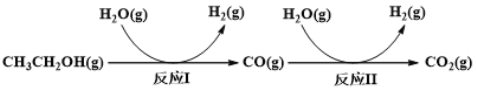
已知:反应I和反应II的平衡常数随温度变化曲线如下图所示。
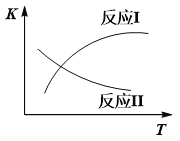
(1)①试说明反应Ⅰ能否发生自发反应______________________________________。
②反应Ⅰ、Ⅱ达平衡后,若在恒温恒压条件下,向体系中充入N2,CO的体积分数会________________(填“上升”、“不变”、“下降”)。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图1

(各点对应的反应温度可能相同,也可能不同)。
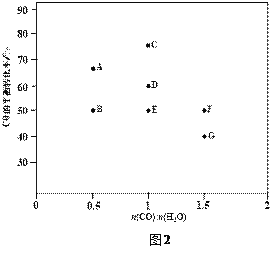
③图中D、E两点对应的反应温度分别为TD和TE。判断:TD______TE(填“<”“=”或“>”)。
④经分析计算,A、E和G三点对应的反应温度相同,理由是_________________________。
⑤在图2中,画出D点所对应温度下CO平衡转化率随进气比[n(CO) : n(H2O)]的曲线。____________
⑥以熔融Na2CO3为电解质的乙醇燃料电池具有广泛的应用,写出其负极的电极反应方程式。________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
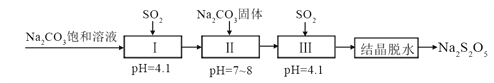
①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
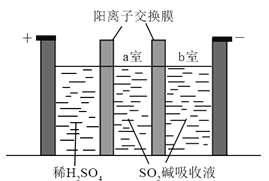
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol钠、镁、铝分别投入到100mL 1mol/L的盐酸溶液中,产生的H2的体积之比(标准状态)是( )
A. 1:1:1 B. 1:2:3 C. 2:1:1 D. 6:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com