
����Ŀ���������ӷ���ʽ�У�������ȷ����
A. ��ʯī�����缫���MgCl2��Һ��2C1-+2H2O![]() C12��+2OH-+H2��
C12��+2OH-+H2��
B. ��ǿ����Һ�д�������������������Ӧ����Na2FeO4��3ClO- + 2Fe(OH)3 �� 2FeO42- + 3Cl- + H2O + 4H+
C. ϡ��ˮ��ͨ�����CO2��NH3��H2O + CO2 ��NH4+ + HCO3-
D. NaHS��ˮ�ⷴӦ��HS-��H2O ![]() S2����H3O+
S2����H3O+
���𰸡�C
��������
A.������þΪ��������ӷ���ʽΪ��Mg2++2C1-+2H2O![]() C12��+Mg(OH)2��+H2������A����
C12��+Mg(OH)2��+H2������A����
B.���Ի����µķ�Ӧ�����ӷ���ʽӦΪ��4OH-+3ClO- + 2Fe(OH)3��2FeO42- + 3Cl- + 5H2O ����B����
C.CO2������������ʽ�Σ����ӷ���ʽΪ��NH3��H2O + CO2 ��NH4+ + HCO3-����C��ȷ��
D.HS-�ȴ��ڵ���ƽ���ִ���ˮ��ƽ�⣬���뷽��ʽΪHS-��H2O ![]() S2����H3O+��ˮ�ⷴӦ�����ӷ���ʽӦΪ��HS-��H2O
S2����H3O+��ˮ�ⷴӦ�����ӷ���ʽӦΪ��HS-��H2O ![]() H2S��OH-����D����
H2S��OH-����D����
�𰸣�C



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��2CH3OH+3O2+4KOH��2K2CO3+6H2O��
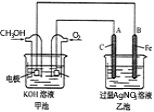
(1)�����_________װ�ã��ҳ���_________װ�á�
(2)ͨ��CH3OH�ĵ缫������_______��A(ʯī)�缫��������________��
(3)ͨ��O2�ĵ缫�ĵ缫��Ӧʽ��________________________��B(Fe)�缫�ĵ缫��ӦʽΪ___________________________��
(4)�ҳ��з�Ӧ�Ļ�ѧ����ʽΪ___________________________��
(5)���ҳ���B(Fe)������������5.40gʱ���׳�������������O2_____mL(��״����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��335��ʱ���ں����ܱշ�Ӧ����1.00mol![]() ������ķ�Ӧ�������£�
������ķ�Ӧ�������£�
��Ӧ1��![]()
��Ӧ2��![]()
���![]() ��
��![]() �IJ���
�IJ���![]() ��
��![]() �������ʵ��������ƣ���ʱ��ı仯��ϵ����Ӧ�����������ı仯��ͼ��ʾ������˵��������ǣ� ��
�������ʵ��������ƣ���ʱ��ı仯��ϵ����Ӧ�����������ı仯��ͼ��ʾ������˵��������ǣ� ��
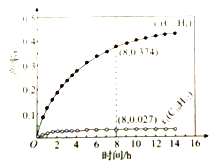
A. ʹ�ô����ܸı䷴Ӧ����
B. ����������![]() ��
��![]() Ҳ����֮�ı�
Ҳ����֮�ı�
C. 8hʱ����Ӧ1��2��δ����ƽ��״̬
D. ![]() ��������
��������![]() �������ڷ�Ӧ2�Ļ�ܱȷ�Ӧ1��С����Ӧ1���ɵ�
�������ڷ�Ӧ2�Ļ�ܱȷ�Ӧ1��С����Ӧ1���ɵ�![]() �ܿ�ת���
�ܿ�ת���![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ��2L���ܱ������У�����4molA��2molB�������·�Ӧ��3A(g)+2B(g)![]() 4C(s)+2D(g)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6mol C��������˵����ȷ���ǣ�������
4C(s)+2D(g)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6mol C��������˵����ȷ���ǣ�������
A. �÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��K=![]()
B. ��ʱ��B��ƽ��ת������40%
C. �������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D. ����B��ƽ�������ƶ�B��ƽ��ת���ʲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ����l0mL0.01mol��L-1NaA��Һ����μ���0.01mol��L-1�����ᣬ�ζ���������ͼ��ʾ������˵����ȷ���ǣ� ��

A. a�㵽c��Ĺ����У�c(HA)+c(A-)=0.01mol��L-1��ʽʼ�ճ���
B. b��ʱ����Һ����Ũ�ȴ�С�Ĺ�ϵ��c(A-)>c(Cl-)>c(HA)>c(OH-)>c(H+)
C. c����Һ���ڵĹ�ϵ��c(Na+)+c(H+)=c(HA)+c(OH-)+2c(A-)
D. ��ͼ��֪����Ũ�ȵ�HA��NaA�����Һ�У�HA�ĵ���̶ȴ���A-��ˮ��̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л������NaOH����H2SO4����CH3COOH����NaCl����CH3COONa����NH4Cl����CH3COONH4����NH4HSO4����NH3H2O����ش��������⣺
(1)NH4Cl��Һ������Ũ�ȴ�С˳��Ϊ______________________��
(2)�����£�pH=11��CH3COONa��Һ�У�ˮ���������c(OH��)=_____����pH=3��CH3COOH��Һ�У�ˮ���������c(H+)=_____��
(3)��֪ˮ��������ƽ�⣺H2O+H2O![]() H3O++OH����H��0������ʹƽ�������ƶ�����������Һ�����ԣ�ѡ������з�����_____��
H3O++OH����H��0������ʹƽ�������ƶ�����������Һ�����ԣ�ѡ������з�����_____��
A.��ˮ�м���NaHSO4���� B.��ˮ�м�NaHCO3����
C.������100��[����c(H+)=1��10��6mol/L] D.��ˮ�м���NH4Cl����
(4)��Ũ�Ⱦ�Ϊ0.1mol/L���������NaOH��NH3H2O�ֱ��ˮϡ��m����n����ϡ�ͺ�������Һ��pH�����9���� m_____n������������������������������
(5)���ʵ���Ũ����ͬ�Ģޡ��ߡ��ࡢ������ϡ��Һ�У�NH4+Ũ���ɴ�С��˳���ǣ�����ţ�_____��
(6)��֪t��ʱ��Kw=1��10-12���ڸ��¶�ʱ��pH=9��NaOH��ҺaL��pH=2��H2SO4��ҺbL���(���Ի�Ϻ���Һ����ı仯)�������û����Һ��pH=3����a��b=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�о�ij��Һ������R�ķֽ����ʵ�Ӱ���������ֱ������ݲ�ͬ��ʼŨ�ȵ�R��Һ�ڲ�ͬ�¶��½���ʵ����c(R)��ʱ��仯��ͼ������˵������ȷ����(����)
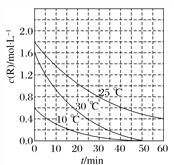
A. 25 ��ʱ����0��30 min����R�ķֽ�ƽ���ٶ�Ϊ0.033 mol��L��1��min��1
B. �Ա�30 ����10 ����������50 minʱ��R�ķֽ�ٷ������
C. �Ա�30 ����25 ����������0��50 min������˵��R�ķֽ�ƽ���ٶ����¶����߶�����
D. �Ա�30 ����10 ����������ͬһʱ������˵��R�ķֽ��������¶����߶�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Se)�Ƕ�������Ӫ��Ԫ�غ�ֲ�������Ӫ��Ԫ�أ������γ�SeO2��H2SeO3��H2SeO4�Ȼ����
(1)����ԭ�ӽṹʾ��ͼ�ɱ�ʾΪ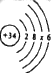 ����x��ֵΪ_____��
����x��ֵΪ_____��
(2)����������Һ��ͨ����������е�����������д���÷�Ӧ�Ļ�ѧ����ʽ�� _______��
(3)��֪��Se(s)��H2(g)��2O2(g)=H2SeO4(s) ��H1��
H2(g)��![]() O2(g)=H2O(l) ��H2��
O2(g)=H2O(l) ��H2��
2SeO2(g)��O2(g)��2H2O(l)=2H2SeO4(s) ��H3��
��ӦSe(s)��O2(g)=SeO2(g)����H��____��(�ú���H1����H2����H3�Ĵ���ʽ��ʾ)
(4)�¶�ΪT��ʱ����2.0L�����ܱ������г���1.0molH2SeO3(g)��������Ӧ��H2SeO3(g)![]() SeO2(g)+H2O(g) ��H=��a kJ/mol��0��10min�����������¶Ȳ��䣬10minʱ�ı�һ������������������H2SeO3(g)��SeO2(g)��H2O(g)�����ʵ�����ʱ��ı仯��ͼ��ʾ��
SeO2(g)+H2O(g) ��H=��a kJ/mol��0��10min�����������¶Ȳ��䣬10minʱ�ı�һ������������������H2SeO3(g)��SeO2(g)��H2O(g)�����ʵ�����ʱ��ı仯��ͼ��ʾ��
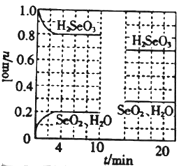
��Ҫ���ƽ��ʱSeO2������������ɲ�ȡ�Ĵ�ʩ��______(����ĸ)��
a.����������䣬���߷�Ӧ�¶�
b.ʹ�ø�Ч����
c.�¶Ⱥ��ݻ����䣬��СH2SeO3����ʼ��
d.�¶Ȳ��䣬ѹ���������������ѹǿ
��0��4min��ƽ����Ӧ����v(H2O)=______��
��10minʱ�ı��������_____��
���¶�ΪT��ʱ���÷�Ӧ��ƽ�ⳣ��KΪ______������ʼʱ��������г���2.0mol H2SeO3(g)��1.0 mol SeO2(g)��0.15 mol H2O(g)����Ӧ�ﵽƽ��ǰ��v(��)____(������������С��������������)v(��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ�����һ�ֿ�������Դ�����п�����Ӧ�õĹ��� ǰ����
ǰ����
��1����֪��CH3OH(g)=HCHO(g)+H2(g) ��H=+84kJmol1,
2H2(g)+O2(g)�T2H2O(g) ��H=484kJmol1
��ҵ�ϳ��Լ״�Ϊԭ����ȡ��ȩ����д��CH3OH(g)��O2(g)��Ӧ����HCHO(g)��H2O(g)���Ȼ�ѧ����ʽ:________________________________________________________________________
��2����һ�ݻ�Ϊ2L���ܱ������ڣ�����0.2molCO��0.4molH2������ӦCO��g��+2H2��g��![]() CH3OH��g���� CO��ƽ��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH��g���� CO��ƽ��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
��A��B�����Ӧ��ѹǿ��С��ϵ��PA________PB���>��<��=����
������������˵��������Ӧ�ܴﵽ��ѧƽ��״̬����___________(�����)
a.H2������������CH3OH�������ʵ�2�� b.CH3OH������������ٸı�
c.���������ܶȲ��ٸı� d.�����ƽ����Է���������ѹǿ���ٸı�
����P1ѹǿ��T1��Cʱ���÷�Ӧ��ƽ�ⳣ��K=_________(�������)
��T1��C��1L���ܱ������ڷ���������Ӧ�����ijʱ�̸����ʵ����ʵ������£�CO��0.1mol�� H2 ��0.2mol�� CH3OH��0.2mol����ʱv�� ________ v������> �� < �� =����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com