
【题目】已知酸性K2Cr2O7溶液可与FeSO4溶液反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
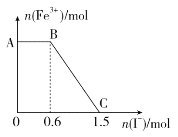
A. 图中AB段的氧化剂为K2Cr2O7
B. 开始加入的K2Cr2O7为0.25 mol
C. K2Cr2O7与FeSO4反应的物质的量之比为1∶3
D. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2
【答案】C
【解析】
氧化性强弱顺序为K2Cr2O7>Fe3+,由图像可知,在反应后的溶液中滴加碘化钾溶液,开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,BC段为铁离子和碘化钾的反应,结合得失电子守恒分析解答。
A.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故A正确;
B.由氧化剂和还原剂得失电子数目相等可知,反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为![]() mol=0.25mol,故B正确;
mol=0.25mol,故B正确;
C.由方程式2Fe3++2I-→2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol∶0.9mol=5∶18,故C错误;
D.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故D正确;
答案选C。


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向体积为2L的恒容密闭容器中通入2molN2和6molH2,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
2NH3(g)。实验测得反应经5min后达到平衡,此时混合物的总物质的量为5.6mol,求:
(1)平衡时NH3的浓度为___mol·L-1。
(2)0~5min内,v(H2)=___mol·L-1·min-1。
(3)反应达到平衡时,N2的转化率为___。
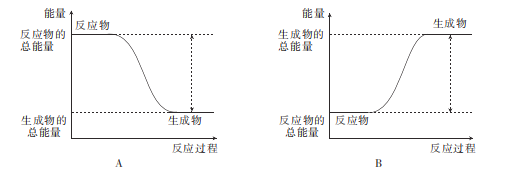
(4)下列图象中能反映该反应的能量变化的是___(填标号)。
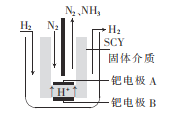
(5)若以N2和H2合成氨的反应设计如图所示的原电池,则通入N2的一极为__(填“正”或“负")极;负极的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发黏、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生在SCl2。
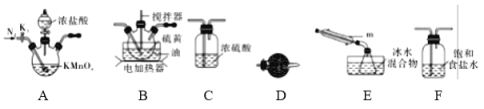
①仪器m的名称为____________,装置F中试剂的作用是____________。
②装置连接顺序:A→________→________→________→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是____________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
![]()
①W溶液可以是____________(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为____________(用含V、m的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 120g NaHSO4晶体中含有NA个SO42-
B. 6.2 g氧化钠和7.8 g过氧化钠的混合物中含有的阴离子总数为0.2NA
C. 4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成氢气分子数为0.1NA
D. NH4Cl+NaNO2=N2↑+NaCl+2H2O,每生成0.1mol N2,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】著名化学家徐光宪获得“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法不正确的是( )
A.铈(Ce)元素在自然界中主要以化合态形式存在
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.四种稳定的核素![]() Ce、
Ce、![]() Ce、
Ce、![]() Ce、
Ce、![]() Ce,它们互称为同位素
Ce,它们互称为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种有机物:
①CH4②CH3CH2OH③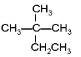 ④癸烷⑤CH2=CH2⑥
④癸烷⑤CH2=CH2⑥![]() ⑦
⑦![]() ⑧
⑧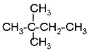 ⑨丙烷
⑨丙烷
请根据上述给出的物质按要求回答下列问题:
(1)相对分子质量为44的烷烃的结构简式为_____________;它与⑧互为_____________关系;
(2)与③互为同分异构体的是_____________(填序号);
(3)在120℃,1.01×105Pa条件下,某种气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃是_____________(填序号);
(4)用“>”表示①③④⑨熔沸点高低顺序:_____________(填序号);
(5)具有特殊气味,常作萃取剂的有机物在催化剂的条件下与液溴发生反应的化学方程式_____________;
(6)有机物②在加热条件下和CuO反应的化学方程式_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂,它们的一些性质及制备方法如下所示:
Ⅰ.氯化铁:熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。工业上采用向500~600 ℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670 ℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
实验室可用如图所示的装置模拟工业生产无水氯化铁,请回答相关问题:
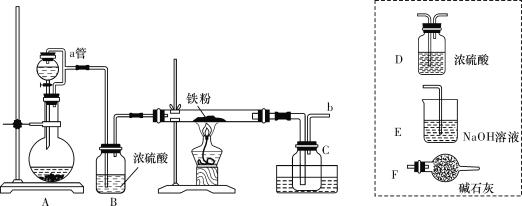
(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为_______。
(2)导管b口应与_______(从虚线框内装置中选择装置后用字母代号填空)连接,这样可避免反应系统与环境间的相互影响。
(3)实验完成后,取广口瓶C中收集到的产物进行如下测定①称取4.52 g样品溶于过量的稀盐酸中;②加入足量H2O2;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40 g。则该样品中铁元素的质量分数为___________%(结果精确到小数点后两位)。
(4)由以上数据分析和计算得出结论:
①用此装置制得的无水氯化铁含铁量______(填“偏高”或“偏低”),显然其中含有较多的__________(填化学式)杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学查询资料后得到如下信息:柠檬烯(![]() )的沸点为177℃,熔点为-74.3℃,密度为0.84 g/mL,具有良好的镇咳、祛痰、抑菌作用,广泛存在于天然的植物精油中。
)的沸点为177℃,熔点为-74.3℃,密度为0.84 g/mL,具有良好的镇咳、祛痰、抑菌作用,广泛存在于天然的植物精油中。
(一)粗精油的提取。该同学利用如图所示装置(加热、夹持及冷凝管内管均省略)从植物组织中获取粗精油,实验步骤如下:
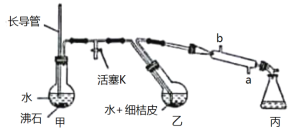
i.将几片桔子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水;
ii.打开活塞K,加热甲至K处的支管口有大量水蒸气冒出时旋紧,再打开冷凝水,水蒸气蒸馏即开始进行。可观察到在馏出液的水面上有一层很薄的油层。
(1)甲中长导管的作用是___________。蒸馏结束时,应先将_____________,再停止加热。
(2)冷凝管的内管应是_________(填“蛇”“球”或“直”)形的。若冷却水从b口进入,则对提取到精油量的影响情况是____________。
(二)柠檬烯的提取。
i.将馏出液加入到仪器A中,然后加入适量的CH2Cl2(沸点为40℃)萃取3次,最后将萃取液置于干燥的锥形瓶中,并加入适量的试剂A干燥半个小时。
ii.将干燥好的溶液加入蒸馏烧瓶中,通过一系列操作,最后烧瓶中剩下的橙黄色液体就是柠檬烯。
(3)仪器A是_________,试剂A可以是_______(写出两种)。若将一定量的橙黄色液体滴入溴的CCl4溶液中,溶液褪色,由此现象可得出的恰当结论是____________。
(4)若桔皮总质量为a g,最后得到V mL柠檬烯,实验过程中柠檬烯的总损失率为b% ,则枯皮中柠檬烯的质量分数为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)。
xC(g)。
Ⅰ.将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a。
Ⅱ.若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,加入3molA,则重新达到平衡时C的体积分数一定减小
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应满足3n(B)>n(A)+3
D.若Ⅱ体系起始物质的量满足3n(C)+8n(A)=12n(B),则可判断x=4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com