
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为:___________________________________,Y元素原子最外层电子的电子排布图为:____________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(3)该化合物的空间结构为______________形,中心原子的轨道杂化类型为__________,分子为______________(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____________。
(5)该化合物的沸点与SiCl4比较:________(填化学式)的高,原因是_________________________。
【答案】1s22s22p63s23p63d104s24p2 ![]() 共价键 正四面体 sp3杂化 非极性分子 范德华力 GeCl4 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高
共价键 正四面体 sp3杂化 非极性分子 范德华力 GeCl4 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高
【解析】
X元素与碳元素同主族且位于周期表中的第一长周期,X为Ge元素,Y原子是短周期元素且最外层电子数比内层电子总数少3,Y为Cl元素,化合物XY4为GeCl4。
(1)Ge元素是32号元素,基态原子核外电子排布式为 [Ar] 3d104s24p2或1s22s22p63s23p63d104s24p2;氯元素原子最外层电子的电子排布图为![]() ;
;
(2)Cl元素与Ge元素的电负性差为2.85-2.1=0.75,小于1.7,所以GeCl4为共价化合物,分子内只含有共价键;
(3)Ge元素与C元素处于相同主族,GeCl4与CCl4 具有相似的结构和性质,Ge原子采取sp3杂化,GeCl4为正四面体形,空间对称,是非极性分子;
(4)GeCl4在常温下为液体,熔点低,由分子构成.微粒间作用力为范德华力;
(5)这两种化合物的结构相似,GeCl4相对分子质量大,分子间作用力强,沸点高。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机物X是一种重要的有机化工原料,下图是以它为初始原料设计出的转化关系图(部分产物、合成路线、反应条件略去),Y是一种功能高分子材料。
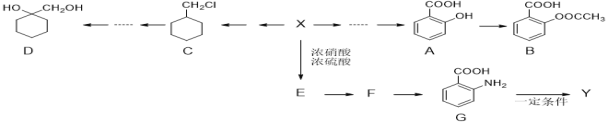
已知:
(1)X为芳香烃,其相对分子质量为92;
(2)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基:![]() ;
;
(3)![]() (苯胺,易被氧化);
(苯胺,易被氧化);
回答下列问题:
(1)X的名称为________________,G的分子式为____________________。
(2)F的结构简式为___________________,B中官能团的名称为____________。
(3)X→E的反应类型为__________________________。
(4)A→B的化学方程式为__________________________。
(5)满足下列条件的B的同分异构体有________种。
①含有苯环;②只含一种官能团;③1 mol该有机物能与2 mol NaHCO3完全反应。
(6)请写出以C为原料制备![]() 的合成路线流程图(无机试剂任用)_________。
的合成路线流程图(无机试剂任用)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸是一种常见的解热镇痛药,结构简式如图所示。下列有关叙述正确的是

A.乙酰水杨酸的分子式为C9H10O4
B.乙酰水杨酸的含氧官能团有三种
C.能与NaHCO3溶液反应的官能团有一种
D.烃基(C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
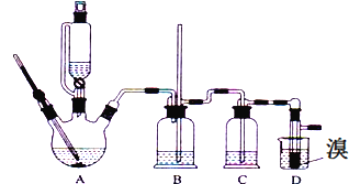
【题目】实验室用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的装置如下图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的需分两步进行,第二步反应的化学方程式为_______________
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”、“下”)。
(5)若产物中有少量未反应的Br2,最好用__________洗涤除去(填选项前字母)。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用__________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.KMnO4 是一种氧化剂,实验室常用 KMnO4和浓盐酸反应制备 Cl2。下图是制备 NaClO溶液的装置图。
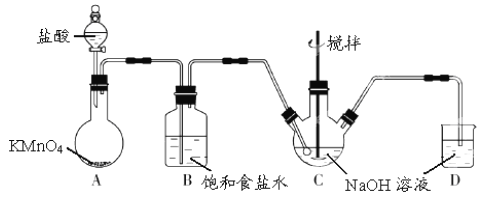
完成下列填空:
(1)KMnO4 稀溶液是一种常见消毒剂,其消毒机理与以下物质相似的是______(选填编号)。
a.75%酒精 b.双氧水 c.NaClO 溶液 d.硫磺皂
(2)B装置中饱和食盐水的作用是___________,D装置中NaOH的作用是______________。
(3)实验操作过程中可调节__________以控制A 装置中产生 Cl2 的气流,C装置需控制反应温度在 0~5℃,实验中可将C 装置放入________________中。
II.测定 KMnO4纯度可用标准 Na2S2O3(式量—158)溶液进行滴定,反应离子方程式为:8MnO4-+5S2O32-+14H+→10SO42-+8Mn2++7H2O。
(4)配制250 mL 0.1000 mol/L标准 Na2S2O3溶液,需准确称取Na2S2O3固体的质量为____g。
(5)取某 KMnO4(式量-158) 产品 0.600g,酸化后用 0.1000 mol/L 标准 Na2S2O3溶液进行滴定,滴定至终点消耗 Na2S2O3溶液 20.00 mL,则该 KMnO4 产品的纯度是_________(保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量为0.2mol,则NaOH的浓度为 ( )
A.1.8mol/LB.2mol/LC.2.4 mol/LD.3.6 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶液中加入新物质时, 其导电性(I)符合下图变化趋势的实验操作是
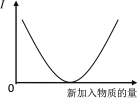
A. 乙酸溶液中通入氨气至过量
B. 石灰水中通入CO2至过量
C. 亚硫酸中通入氯气至过量
D. 氨水中通入氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com