
下列所述变化规律正确的是( )
A.Na、Mg、Al还原性依次增强 B.HCl、PH3、H2S稳定性依次减弱
C.NaOH、KOH、CsOH碱性依次增强 D.S2-、Cl-、K+、Ca2+离子半径依次增大
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:______________________、________________________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又 将Br2还原为Br-,其目的为________________________________________________________________________。
将Br2还原为Br-,其目的为________________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为________________________________________________________________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________________________________________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称:________________;
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为________________________________________________________________________;
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________________________________________________________;
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
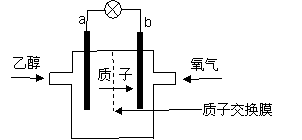 一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:
一种新型的乙醇电池(DEFC)用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为: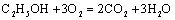 。下列说法正确的是( )
。下列说法正确的是( )
A.a极为电池的正极
B.电池正极的电极反应式为: 4H++O2+4 e-=2H2O
C.电池工作时电流由a极沿导线经灯泡再到b极
D.设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6 NAq库仑的电
量(NA代表阿佛加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关烷烃的叙述中,正确的是( )
①在烷烃分子中,所有的化学键都是单键 ②烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去 ③分子通式为CnH2n+2的烃不一定是烷烃 ④所有的烷烃在光照条件下都能与氯气发生取代反应 ⑤光照条件下,乙烷通入溴水中,可使溴水褪色
A.①③⑤ B.②③ C.①④ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应变化过程及结果的研究。按要求回答问题:
(1)关于反应过程中能量变化的研究:
已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H= -a kJ/mol
②CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H= -b kJ/mol
③H2O (g)= H2O(l) △H= -c kJ/mol
则:2CO(g)+O2(g)=2CO2(g)△H= kJ·mol-1。
(2)关于反应速率和限度的研究:
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数(K)和温度(T / ℃)关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
①焓变ΔH _______0 (填“>”、“<”或“=”)。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)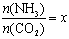 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。

下例说法正确的是
(A)NH3的平衡转化率随着x增大而增大,上图中的B点处,NH3的平衡转化率为32%
(B)上图中的D点处,未达到平衡状态,且v(正) < v(逆)
(C)当反应体系中H2O的质量不再改变时,反应达到平衡状态
(3)关于电化学的研究:
Na2FeO4和Zn可以组成碱性电池,其反应的离子方程式为:
2FeO42- + 3Zn + 8H2O = 3Zn(OH)2+ 2Fe (OH)3+4 OH-,请写出放电时正极的电极反应式 。用该电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。当高铁电池中有3.32g Na2FeO4放电时,电解尿素[CO(NH2)2]的碱性溶液的阴阳两极共收集的气体体积为 mL(标准状况下)。
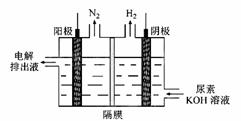
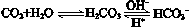 (4)关于电离平衡的研究:
(4)关于电离平衡的研究:
人体血液里存在重要的酸碱平衡: ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
| c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
试回答:
①正常人体血液中,HCO3-的水解程度 电离程度(填“大于”、“小于”、“等于”);
②人体血液酸中毒时,可注射 缓解(填选项);
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是________(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是__________(填化学式),反应的化学方程式为____________________________________________________________。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有________(填序号)。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液____________,说明这种气体具有__________性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:______________
__________________________________________________________。
(5)能否用澄清石灰水鉴别这两种气体?________(填“能”或“不能”),若不能,请填写两种能鉴别的试剂______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com