
【题目】下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
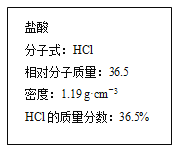
(1)该浓盐酸中HCl的物质的量浓度为________mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②配制仪器除烧杯、玻璃棒、量筒,还需要的仪器是 _______、
③配制时,下列操作正确的顺序是(用字母表示)______。
A. 洗涤 B. 定容 C. 稀释 D. 摇匀 E. 冷却 F. 量取 G. 转移
④在配制过程中,下列实验操作使配制的稀盐酸的物质的量浓度偏小的是_______
A. 用量筒量取浓盐酸时俯视刻度线
B. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C. 配制时,容量瓶有少量蒸馏水
D. 定容时俯视容量瓶的刻度线
E. 转移完溶液后未洗涤玻璃棒和烧杯
【答案】11.9 16.8 500mL容量瓶、胶头滴管 FCEGABD ABE
【解析】
(1)利用公式![]() 可求出浓盐酸中HCl的物质的量浓度。
可求出浓盐酸中HCl的物质的量浓度。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L稀盐酸。
①利用稀释前后溶质的物质的量相等,可求出所需上述浓盐酸的体积;
②配制仪器除烧杯、玻璃棒、量筒,还需要的仪器是容量瓶和胶头滴管;
③配制时,操作的正确顺序,按配制溶液时的操作步骤进行排序;
④利用公式![]() 进行
进行
A. 用量筒量取浓盐酸时俯视刻度线,n偏小;
B. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,V偏大;
C. 配制时,容量瓶有少量蒸馏水,n、V都不变;
D. 定容时俯视容量瓶的刻度线,V偏小;
E. 转移完溶液后未洗涤玻璃棒和烧杯,n偏小。
(1)![]() =11.9 mol·L-1。答案为:11.9;
=11.9 mol·L-1。答案为:11.9;
(2)①设所需浓盐酸的体积为V,11.9mol/L×V=0.400 mol/L×500mL,V=16.8mL;答案为:16.8;
②配制仪器除烧杯、玻璃棒、量筒,还需要的仪器是容量瓶和胶头滴管;答案为:500mL容量瓶、胶头滴管;
③配制时,按配制溶液时的操作步骤进行排序,即为FCEGABD;答案为:FCEGABD;
④利用公式![]() 进行
进行
A. 用量筒量取浓盐酸时俯视刻度线,n偏小,c偏小;
B. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水,V偏大,c偏小;
C. 配制时,容量瓶有少量蒸馏水,n、V都不变,c不变;
D. 定容时俯视容量瓶的刻度线,V偏小,c偏大;
E. 转移完溶液后未洗涤玻璃棒和烧杯,n偏小,c偏小。
综合以上分析,ABE操作,使配制的稀盐酸的物质的量浓度偏小。答案为:ABE。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 比较Cl2与H2SO4氧化性强弱 | 向漂白粉中加入4mol·L-1硫酸,观察有无黄绿色气体 |
B | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3稀溶液,出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
D | 向苯酚钠溶液中通入CO2,溶液变浑浊 | 结合H+能力: C6H5O->CO32- >HCO3- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
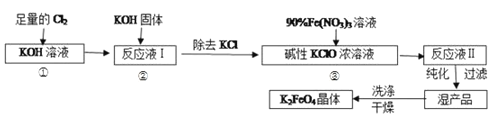
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
回答下列问题:实验室可利用如图装置完成流程①和②

(1)写出工业上制取Cl2的化学方程式__;两水槽中的水为___(填“热水”或“冷水”)。
(2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是___;
A.为下一步反应提供碱性的环境
B.使KClO3转化为 KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:___。
(4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和的KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是___。
②如何判断 K2FeO4 晶体已经洗涤干净__。
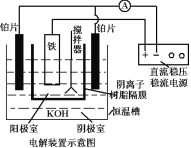
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图,电解过程中阳极的电极反应式为___。
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是___。
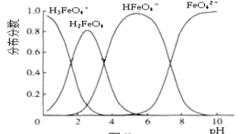
A.不论溶液的酸碱性如何变化,铁元素都有4 种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6 的这种溶液中加KOH溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.
已知该反应中H2O2只发生如下过程:H2O2―→O2.
①该反应中的还原剂是____________.
②该反应中,发生还原反应的过程是____________→____________.
③写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目_______
④如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为____________
(Ⅱ)已知实验室利用KMnO4溶液和浓盐酸反应制取Cl2,请回答下列问题:
①配平此化学方程式:
____KMnO4+____HCl(浓)— ____KCl+____MnCl2+____Cl2↑+____H2O
②把此化学方程式改写成离子方程式: ________
③被氧化的HCl 与未被氧化的HCl物质的量之比为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入V L c mol·L-1的HNO3溶液(过量)中,充分反应,产生气体为NO,则反应后溶液中NO3-的量为( )
A.62(a+b) gB.186(a+b) gC.![]() molD.
molD.![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些氮的化合物是引起大气污染、水体污染和土壤污染原因之一。
I.汽车和工业废气中的氮氧化物是城市空气污染的主要来源。氮氧化物处理通常有下列途径:
(1)在汽车排气管内安装催化转化器,其反应为2NO(g) +2CO(g)= 2CO2(g) +N2(g)。
①该反应能够正向自发进行,则正反应的ΔH_________0(填“>”或“<”)。
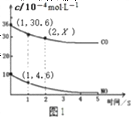
②根据传感器记录某温度下,NO、CO的反应进程,测量所得数据绘制出图1。前1s内平均反应速率v(N2)=__________mol/(L·s);第2s时的X值范围_________________________。
(2)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)![]() CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
II.氰化钠是一种重要的基本化工原料。“天津港”爆炸中,氰化钠产生泄漏,为了避免给土壤和水体带来污染,消防员通过喷洒双氧水来处理泄漏的氰化钠。
(3)已知:NaCN + H2O2+ H2O=NaHCO3+ NH3↑,用H2O2处理1mol NaCN时,反应中转移电子的物质的量为_________mol(NaCN中C为+2价)。
(4)某兴趣小组检测处理后的氰化钠废水是否达标。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-= [Ag(CN)2]-,Ag++I-= AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4mol/L的AgNO3标准溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_________。
⑤经计算处理后的废水中NaCN的浓度为_________mg/L(保留两位小数),处理后的废水是否达到排放标准:________(填“是”或“否”)
III.工业废水中,含有NaNO2。NaNO2固体外观酷似食盐,误食会中毒。可用电解法将废水中少量的![]() 转化为N2以降低其危害。写出
转化为N2以降低其危害。写出![]() 在酸性条件下转化为氮气的电极反应式为_____________。
在酸性条件下转化为氮气的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸氢钠粉末,pH增大,溶液漂白性增强
D. 光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所混有的少量杂质,括号内为杂质。指明应加入的试剂,写出有关方程式。
(1)Fe粉(Al粉):试剂___离子方程式___;
(2)FeCl2溶液(FeCl3):试剂___离子方程式___;
(3)Na2CO3固体(NaHCO3):化学方程式___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com