
【题目】在体积为V L的密闭容器中通入a mol CO和b mol O2,点燃充分反应后容器内碳原子数和氧原子数之比为( )
A. a:b B. a:2b
C. a:(a+2b) D. a:2(a+b)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】对于在一定条件下密闭容器中进行的反应N2+3H2 ![]() 2NH3 , 下列有关推断正确的是( )
2NH3 , 下列有关推断正确的是( )
A.3molH2与足量的N2在该容器内充分反应可生成2molNH3
B.当生成N2和NH3的速率之比为1:2时反应处于平衡状态
C.在相同的温度和压强下,与不使用催化剂相比,使用催化剂可以提高平衡混合物中NH3的含量
D.当反应速率之比v(N2):v(H2):v(NH3)=1:3:2时,反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.48g铁铜合金完全溶解于80mL 4.0molL﹣1稀硝酸中,得到标准状况下672mL NO气体(假设此时无其他气体产生),下列说法正确的是( )
A.取反应后溶液,滴入几滴KSCN溶液,无血红色出现
B.该合金中铁与铜的物质的量之比是1:2
C.反应后溶液(忽略溶液体积变化)中c(H+)=2.5 molL﹣1
D.向反应后的溶液中加入2.0 molL﹣1NaOH溶液至金属离子恰好全部沉淀时,需加入NaOH溶液的体积是120 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3![]() Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:__________________。
(2)反应I的化学方程式为________________________。
(3)“灼烧”时发生反应的化学方程式:______________。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为__________________。
(5)副产品X的化学式是____________。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH= 2K2CO3+6H2O
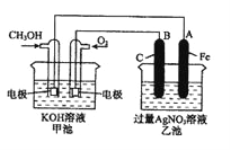
(1)乙池是__________装置。
(2)通入CH3OH的电极名称是______________________
(3)通入O2的电极的电极反应式是__________________________。若甲池用熔融碳酸盐为电解质,则通入O2的电极的电极反应式为___________________。
(4)乙池中反应的化学方程式为_______________________________。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_________mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH都相同
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为-241.8kJ/mol
C. 在稀溶液中H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 molNaOH的稀溶液混合,放出的热量为57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用酸性高锰酸钾溶液可以鉴别己烯、甲苯和苯
B.用系统命名法命名顺﹣2﹣丁烯、反﹣2﹣丁烯分别与HCl加成产物的结果不同
C.聚乳酸(  )分子中存在酯基、羧基、羟基
)分子中存在酯基、羧基、羟基
D.有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中10种元素回答以下问题:

Ⅰ.填写下列空白:
(1)写出⑧元素在周期表的位置______________________;
(2)实验室制取②氢化物的化学方程式_______________________________________;
②的氢化物与其最高价氧化物水化物反应生成的物质是________________(填名称)
(3)⑦的氯化物物理性质非常特殊,如熔点为190℃,但在180℃就开始升华。据此判断该氯化物是________(填“共价化合物”或“离子化合物”),可以证明你判断正确的实验依据为:_____________________________________________________________________。
(4)用电子式表示④、⑥两元素结合成化合物的形成过程____________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图中的变化,其中A是一种淡黄色固体,可作供氧剂;X是一种氢化物,常温下为液体,则:
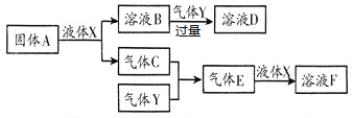
(1)A的电子式为_________________;
(2)气体Y是一种大气污染物,无色有刺激性气味,直接排放会形成酸雨。写出溶液D与酸性高锰酸钾溶液反应的离子方程式:_________________________________________;
(3)在含2molF的浓溶液中加入1mol锌片加热使之充分反应,产生气体的体积为_____ L(标准状况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com