
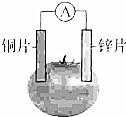
 甲乙两位同学一起做水果电池的实验,测得数据如下:
甲乙两位同学一起做水果电池的实验,测得数据如下:| 试验编号 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑桔 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
| A. | ③ | B. | ① | C. | ①②③ | D. | ②③ |
分析 ①锌、铝和水果形成原电池时,铝易失电子作负极,锌作正极;
②形成的原电池中,较活泼的金属易失电子而作负极;
③根据图表中金属、电极和电压的关系分析.
解答 解:①锌、铝和水果形成原电池时,铝易失电子作负极,则锌作正极,负极上铝失电子发生氧化反应,反应为Al-3e-=Al3+,故①正确;
②形成的原电池中,较活泼的金属易失电子而作负极,较不活泼的金属作正极,所以实验1中锌比铜活泼,锌为负极,5中铝比锌活泼,铝为负极,故②正确;
③根据图表知,当1、2比较时,电极材料相同,水果不同,导致电压不同,所以电压与水果有关;比较1、5时,水果相同,电极材料不同,电压不同,所以电压与电极材料有关,故③错误;
故选A.
点评 本题考查了原电池原理,知道原电池中正负极的判断方法、会根据图表分析即可解答,题目难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:选择题
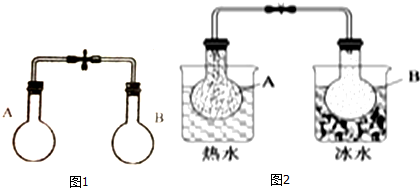
| A. | 图2中,B烧瓶颜色较深 | |
| B. | 图2中,B烧瓶与A烧瓶相比有较多的NO2 | |
| C. | 图2中B烧瓶的正反应速率比图1中B烧瓶的快 | |
| D. | 图2中A烧瓶的正反应速率比图1中A烧瓶的快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烃有3种同分异构体 | |
| B. | 已知丙烷的二氯代物有4种同分异构体,则其六氯代物的同分异构体数目也为4种 | |
| C. | 含有5碳原子的饱和链烃,其一氯代物只有3种 | |
| D. | 菲的结构为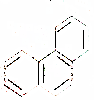 ,它与硝酸反应,可生成5种一硝基取代物 ,它与硝酸反应,可生成5种一硝基取代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
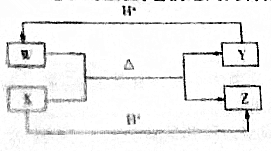
| A. | W的电子式为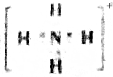 | |
| B. | Y与Z之间可形成氢键 | |
| C. | 硫酸与氢氧化钠溶液反应的离子方程式可表示为X+H+=Z | |
| D. | 微粒Y中各元素原子均达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 用带玻璃塞的磨口瓶盛放NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原HA溶液中,c(H+)=c(A-) | |
| B. | 当恰好完全中和时,溶液呈中性 | |
| C. | 当NaOH溶液过量时,可能出现:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴入少量的NaOH,促进了HA的电离,溶液的pH升高 |
查看答案和解析>>
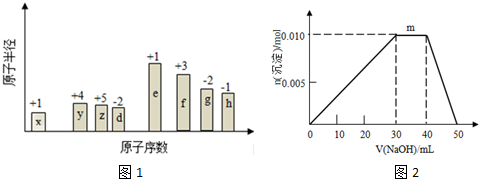
科目:高中化学 来源: 题型:多选题
| A. | 当V=10时,c(Na+)>c(OH-)>c(HC0${\;}_{3}^{-}$)>c(CH3COO-)>c(H+) | |
| B. | 当 0<V<20 时,c(H+)+c(Na+)=c(HC0${\;}_{3}^{-}$)+c(CH3COO-)+2 c(C032-)+c(OH-) | |
| C. | 当 V=20 时,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 当 V=40 时,c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
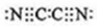 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com