
����Ŀ����98%��ŨH2SO4����=1.84g/cm3������500ml0.5mol/L��ϡH2SO4 �� �밴Ҫ����գ�
��1������ŨH2SO4�����Ϊ
��2�����ʵ������10mL��20mL��50mL��Ͳ��Ӧѡ��mL��Ͳ��ʵ�����õ������������ձ���������֮�⣬����Ҫ�������У�
��3����ʵ���г������������������ҺŨ����ʲôӰ�죿����ƫ�ߡ�ƫ�͡���Ӱ�죩
��Ũ�����ܽ��δ�������¼�ת�Ƶ�����ƿ
�ڶ���ʱ���ӿ̶���
�����ù����ձ���������δϴ�� ��
���𰸡�
��1��13.6mL
��2��20,��ͷ�ιܡ�500mL����ƿ
��3��ƫ��,ƫ��,ƫ��
���������⣺��1����ŨH2SO4�����ʵ���Ũ��Ϊ��c= ![]() mol/L=18.4mol/L��
mol/L=18.4mol/L��
����ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬������Ũ������������Ũ��������ΪxL������xL��18.4mol/L=0.5L��0.5mol/L��
��ã�x��0.013.6L=13.6mL������Ӧ��ȡ��Ũ���������13.6mL��
��2�����Ʋ�������ȡ��ϡ�͡���Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ������Ͳ��ȡ���õ���ͷ�ιܣ����������ձ���ϡ�ͣ���ȴ��ת�Ƶ�500mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ������Ϊ�����������ձ�����ͷ�ιܡ�20mL��Ͳ��500mL����ƿ����ȱ�ٽ�ͷ�ιܺ�500mL����ƿ��
��3����Ũ�����ܽ��δ�������¼�����ת�ơ����ݣ�һ����ȴ�����ᵼ�����ƫС���������Ƶ���Һ���ƫС�����Ƶ���ҺŨ��ƫ�ߣ�
�ڶ���ʱ���ӿ̶��ߣ��������Ƶ���Һ���ƫС����ҺŨ��ƫ�ߣ�
�����ù����ձ���������δϴ�ӣ����Ƶ���Һ�����ʵ����ʵ���ƫС����ҺŨ��ƫ�ͣ�
�ʴ�Ϊ����1��13.6mL����2��20����ͷ�ιܡ�500mL����ƿ����3����ƫ�ߣ���ƫ�ߣ���ƫ��
��1�����ݹ�ʽ![]() ����Ũ�����Ũ�ȣ����ϡ���������ʵ����ʵ������䣬��������Ũ����������
����Ũ�����Ũ�ȣ����ϡ���������ʵ����ʵ������䣬��������Ũ����������
��2����������õ�Ũ����������ȷ��������Ͳ�����̣�ʵ�����������������ɽ��ʵ�鲽�����ȷ����
��3����Ũ����ϡ���̻�ų�������Һ��������ܵ���������������Ӱ�죻
�ڶ���ʱ���ӿ̶��ߣ�����������Һ�����ƫС��
���ձ���������δϴ�ӣ��ᵼ��������Һ�����ʵ���ƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱAgl������Һ��c��Ag+��Ϊ1.22��10��6mol/L��AgCl�ı�����Һ��c��Ag+��Ϊ1.25��10��6mol/L������5mL����KCl��KI��Ϊ0.01mol/L����Һ�У�����8mL0.01mol/LAgNO3��Һ����ʱ��Һ���������ʵ�����Ũ�ȴ�С��ϵ��ȷ���ǣ� ��
A.c��K+����c��NO![]() ����c��Cl������c��Ag+����c��I����
����c��Cl������c��Ag+����c��I����
B.c��K+����c��NO![]() ����c��Ag+����c��Cl������c��I����
����c��Ag+����c��Cl������c��I����
C.c��NO3������c��K+����c��Ag+����c��Cl������c��I����
D.c��K+����c��NO ![]() ����c��Ag+��=��Cl����+c��I����
����c��Ag+��=��Cl����+c��I����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���Ҫ�ɷ������������
A����Ȼ�� B.ˮú�� C������ D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25��ʱ0.1mol/L�İ�ˮ����ش��������⣺
������ˮ�м�����������粒��壬��ʱ��Һ�� ![]() �����������С�����䡱����
�����������С�����䡱����
������ˮ�м���ϡ���ᣬʹ��ǡ���кͣ�������Һ��pH7���������������=�����������ӷ���ʽ��ʾ��ԭ�� ��
������ˮ�м���ϡ��������Һ��pH=7����ʱc��NH4+��=a mol/L����c��SO42����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.1molL��1��HA��Һ��c��H+��/c��OH����=1010 �� ��ش��������⣺
��HA�� ���ǿ����ʡ���������ʡ�����
���ڼ�ˮϡ��HA��Һ�Ĺ����У�����ˮ�������Ӷ���С���� ������ĸ����
A��c��H+��/c��HA���� B��c��HA��/��A���� C��c��H+����c��OH�����ij˻� ��D��c��OH����
����M��Һ��������HA��ҺV1mL��pH=12��NaOH��ҺV2mL��ϳ�ַ�Ӧ���ã�������˵������ȷ���� ��
A������ҺM�����ԣ�����ҺM��c��H+��+c��OH����=2.0��10��7 molL��1
B����V1=V2 �� ����ҺM��pHһ������7
C������ҺM�����ԣ�V1һ������V2
D������ҺM�ʼ��ԣ�V1һ��С��V2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ƺ������ƵĻ������������ˮ��ַ�Ӧ���õ�0.36g��������200mL��Һ��������������������зŵ磬�����������
��1���������й������Ƶ�����������
��2����������Һ�����ʵ���Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������Ӽ������ӻ������˵������ȷ���ǣ� ��
A.�ۻ�״̬���ܹ���������ʣ�һ�������ӻ�����
B.���ӻ�������ɷǽ���Ԫ�غͽ���Ԫ�ع�ͬ���
C.���ӻ�����һ��������ˮ
D.�������Ӽ��Ļ�����һ�������ӻ�������γɾ��壬��Ϊ���Ӿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���dz��������巢��װ�ã�V��VI�������ռ�װ�ã�����Ҫ�������������⣺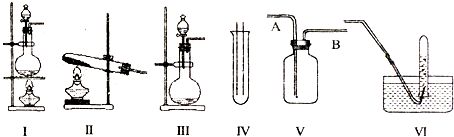
��1�����巢��װ�õ�ѡ������CaCO3�����ᷴӦ��CO2 �� ���ѡ����������ţ�����Iװ����ȡ��������Ũ����Ӧʢ��������I�е��������ƣ���д��ʵ������ȡ�����Ļ�ѧ����ʽ ��
��2���ռ�װ�õ�ѡ����ѡ��VΪ�����ռ�װ�ã�������Ӧ����ͨ�룮�û�ѧ�������������ռ����ķ����� ��
��3��ʵ������ȡ���������������Ҫ����β��������һ�㽫β��ͨ�뵽��Һ�У��䷢����Ӧ�Ļ�ѧ����ʽΪ ��
��4����������գ��������鷢�֣���1�����ˮ������336�����HCl���ҵõ�����Һ���ܶ�Ϊ1.08g/cm3 �� ��������Һ�����ʵ����ʵ���Ũ��Ϊmol/L��������һλС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��־����ۻ�ʱֻ��˷����Ӽ�����������
A.NaClB.�ɱ�C.SiO2D.C6H5ONa
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com