
NO2和N2O4的混合气体与O2以12∶5体积比混合后通入水中能恰好完全反应,则NO2和N2O4气体的体积比是
[ ]
|
A.1∶1 |
B.1∶2 |
|
C.1∶3 |
D.2∶3 |
科目:高中化学 来源: 题型:阅读理解
| a |
| b |
| 5 |
| 6 |
| a |
| b |
| 5 |
| 6 |
| 1.2a +b |
| 8.96 |
| 1.2a +b |
| 8.96 |
| 2.016 |
| 22.4 |
| 0.896 |
| 22.4 |
| 2.016 |
| 22.4 |
| 0.896 |
| 22.4 |
查看答案和解析>>
科目:高中化学 来源:江苏省扬州中学2011-2012学年高一下学期期中考试化学试题 题型:021
|
设NA为阿伏加德罗常数的值,下列叙述正确的是 | |
A. |
1 L 0.1 mol/L氨水中含有0.1NA个NH4+ |
B. |
常温常压下,12 g 14C所含原子数为NA |
C. |
1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均得到2NA个电子 |
D. |
46 g NO2和N2O4混和气体中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源:2011年8月份高考百题精练(2)化学试题 题型:013
|
设NA为阿伏伽德罗常数,下列叙述不正确的是 | |
| [ ] | |
A. |
0.2 mol Mg在空气中完全燃烧生成C、MgO和Mg3N2混和物时,失去的电子数为0.4NA |
B. |
1 L 1 mol·L-1的次氯酸钠溶液中含有ClO-的个数少于NA |
C. |
46 g NO2和N2O4混合气体中含有原子数为3NA |
D. |
标准状况下,NA个SO3分子所占的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示25℃时,在烧杯A中装有50.0 mL水,烧杯B中装有0.50 mol?L-1盐酸50.0 mL,把NO2和N2O4的混和气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放人A烧杯中,D烧瓶放人B烧瓶中。往A烧杯中加入50.0 g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后。回答下列问题:
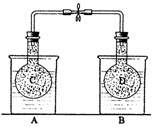
![]()
(1) 烧杯B中温度(填“升高”、“降低”或“不变”)__________。
![]() (2)已知在NO2生成N2O4的可逆反应: 2NO2(g)
(2)已知在NO2生成N2O4的可逆反应: 2NO2(g) ![]() N2O4(g) △H<O,从上面实验可知C烧瓶内混和气体颜色(填“变浅”、“变深”或“不变”)______;
N2O4(g) △H<O,从上面实验可知C烧瓶内混和气体颜色(填“变浅”、“变深”或“不变”)______;
![]() (3)若实验测得B烧杯中酸碱中和反应放热1.4325 kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为___________。
(3)若实验测得B烧杯中酸碱中和反应放热1.4325 kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为___________。
![]() (4)若起始时在D烧瓶中充人m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g)
(4)若起始时在D烧瓶中充人m g N2O4,此时测得烧瓶中压强为1.01×105Pa,当可逆反应:N2O4(g) ![]() 2NO2达到化学平衡状态时压强变为1.515×105Pa,则平衡混和气体的平均相对分子质量为:__________________。(精确到小数点后两位)
2NO2达到化学平衡状态时压强变为1.515×105Pa,则平衡混和气体的平均相对分子质量为:__________________。(精确到小数点后两位)
![]()
![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com