
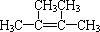 ;
;
分析 (1)红外光谱表明分子中含有碳碳双键,且属于烯烃,其相对分子质量为84,根据烯烃的通式CnH2n,可以得出n=6,即为己烯,分子内所有氢原子都处于相同的化学环境,所有的氢原子是完全对称等效的,其结构简式为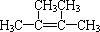 ,以此解答该题;
,以此解答该题;
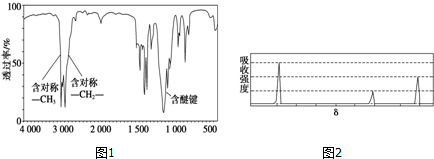
(2)根据质谱图可知该有机物的相对原子质量为74,红外光谱图显示存在对称的甲基、对称的亚甲基和醚键可得分子结构;
(3)有机物能与金属Na反应产生无色气体,说明含有-OH或-COOH;又能与碳酸钠反应产生无色气体,说明含有-COOH;还可以使溴的四氯化碳溶液褪色,说明含有不饱和键 或-C≡C-,根据含氧元素的质量分数为37.21%,相对分子质量不超过100,确定分子中氧原子个数,进而确定有机物的相对分子质量,确定有机物的分子式;根据核磁共振氢谱确定分子中氢原子类型,结合可能的官能团,确定有机物结构,据此进行解答.
或-C≡C-,根据含氧元素的质量分数为37.21%,相对分子质量不超过100,确定分子中氧原子个数,进而确定有机物的相对分子质量,确定有机物的分子式;根据核磁共振氢谱确定分子中氢原子类型,结合可能的官能团,确定有机物结构,据此进行解答.
解答 解:(1)①分子中含有碳碳双键,确定属于烯烃,其相对分子质量为84,根据烯烃的通式CnH2n,可以得出n=6,即为己烯,分子内所有氢原子都处于相同的化学环境,所有的氢原子是完全对称等效的,则A的结构简式为: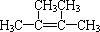 ,
,
故答案为: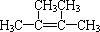 ;
;
②根据乙烯中所有的原子均是共面的,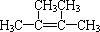 中的非双键碳原子可以等效为乙烯中的四个氢原子,所以所有的碳原子均是共面的,
中的非双键碳原子可以等效为乙烯中的四个氢原子,所以所有的碳原子均是共面的,
故答案为:是;
(2)质谱图可知该有机物的相对原子质量为74,红外光谱图显示存在对称的甲基、对称的亚甲基和醚键可得分子的结构简式为:CH3CH2OCH2CH3,
故答案为:CH3CH2OCH2CH3;
(3)有机物中氧元素的质量分数为37.21%,相对分子质量不超过100,所以分子中氧原子数目N(O)<$\frac{100×37.21%}{16}$=2.3,该有机物能与碳酸钠反应产生无色气体,说明含有-COOH,所以O原子数为2,可知其相对原子质量为:$\frac{16×2}{37.21%}$=86,其摩尔质量为86g/mol;又因为C完全燃烧只生成CO2和H2O,所以只含有碳、氢、氧三种元素,设其化学式为:CaHb-COOH,根据C的相对分子质量为86可知CaHb-的式量为:12a+b=41,若a=1,则b=29不符合烃基结构;若a=2,则b=17不符合烃基结构;若a=3,则b=5成立,故该有机物的分子式为C4H6O2,其不饱和度为:$\frac{4×2+2-6}{2}$=2,含有一个羧基,且B能够使溴的四氯化碳溶液褪色,所以还应有1个碳碳双键,从核磁共振检测发现C有三种布同环境下的氢原子,所以其结构简式为:CH2=C(CH3)-COOH,
故答案为:86g/mol;CH2=C(CH3)-COOH.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握守恒思想在确定有机物分子式中的应用方法,试题培养了学生的分析能力及化学计算能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1s22s12p1 | B. | 1s22s22p63s23p64s1 | ||
| C. | 1s22s22p33s1 | D. | 1s22s22p63s13p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳与水反应吸收131.3 kJ的热量 | |
| B. | 1 mol碳和1 mol水反应吸收131.3 kJ的热量 | |
| C. | 1 mol固态碳与1 mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量 | |
| D. | 固态碳和气态水各1 mol反应,放出131.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 39g K 与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 含4 molHCl的浓盐酸和足量MnO2加热反应可生成NA个Cl2分子 | |
| C. | 标准状况下,22.4L 氟化氢中含2NA个原子 | |
| D. | 2mol单质Cu与足量高温硫蒸气完全反应,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的物质是氧化剂 | |
| B. | 失去电子,化合价降低的物质是还原剂 | |
| C. | 还原剂被还原,氧化剂被氧化 | |
| D. | 得到电子,化合价降低的反应物是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯是无色无味的液态径,不易燃烧 | |
| B. | 苯与浓硝酸、浓硫酸混合共热可制取硝基苯 | |
| C. | 溴水能与苯发生加成反应而褪色 | |
| D. | 在一定条件下苯与氢气反应制取环己烷,说明苯分子结构中有碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com