
【题目】以下为三种有机物的有关信息,根据表中信息回答问题.
A | B | C |
其产量用来衡量一个国家的石油化工水平 | 比例模型为: | 沼气主要成分 |
(1)A结构简式是 . 该物质能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色.其中,与高锰酸钾溶发生的反应是(填反应类型);与溴反应的化学方程式为 , 当溴的四氯化碳溶液质量增加2.8g时,生成物的质量为 .
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为 .
(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为 .
【答案】
(1)CH2=CH2;氧化反应;CH2=CH2+Br2→CH2BrCH2Br;18.8g
(2)![]()
(3)CH4+2Cl2 ![]() CH2Cl2+2HCl
CH2Cl2+2HCl
【解析】解:A产量用来衡量一个国家的石油化工水平,为CH2=CH2 , 由B的比例模型可知B为苯,C为沼气主要成分,应为CH4 , (1)A为乙烯,结构简式是,含有碳碳双键,可被酸性高锰酸钾氧化,乙烯与溴发生加成反应,方程式为CH2=CH2+Br2→CH2BrCH2Br,当溴的四氯化碳溶液质量增加2.8g时,说明有0.1mol乙烯参加,则生成0.1molCH2BrCH2Br生成,质量为18.8g,所以答案是:CH2=CH2;氧化反应;CH2=CH2+Br2→CH2BrCH2Br;18.8g;(2)苯与浓硝酸在浓硫酸作用下发生取代反应生成硝基苯,方程式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)甲烷与氯气在光照条件下发生取代反应生成二氯甲烷和氯化氢,方程式为CH4+2Cl2
;(3)甲烷与氯气在光照条件下发生取代反应生成二氯甲烷和氯化氢,方程式为CH4+2Cl2 ![]() CH2Cl2+2HCl,所以答案是:CH4+2Cl2
CH2Cl2+2HCl,所以答案是:CH4+2Cl2 ![]() CH2Cl2+2HCl.
CH2Cl2+2HCl.


科目:高中化学 来源: 题型:
【题目】下列各组物质中,其学名、俗名及化学式不相符合的是( )
A. 碳酸钠、纯碱、Na2CO3 B. 碳酸氢钠、小苏打、NaHCO3
C. 氢氧化钠、火碱、NaOH D. 碳酸钙、生石灰、CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可再生能源和清洁能源将成为新能源的主力军,下列关于能源的叙述正确的是
A.化石燃料是可再生能源B.氢能、太阳能是清洁能源
C.化石燃料都是清洁能源D.海洋能、地热能是不可再生的清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是
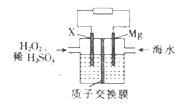
A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2 mol电子,则有2 mol H+由质子交换膜左侧向右侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)联氨是一种可燃性液体,可用作火箭燃料。已知32.0gN2H4和H2O2反应生成氮气和水(气态),放出热量642kJ,该反应的热化学方程式是:____________。
(2)取300mL0.2mo/L的KI溶液与一定量的KMnO4溶液恰好反应,生成等物质的量I2和KIO3,则消耗KMnO4的物质的量是__________mol。
(3)以甲醇(CH3OH) 为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:__________。
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2) 固体制备二氧化氯的方法,其化学方程式为___________。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是__________,又变为棕黄色的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉. 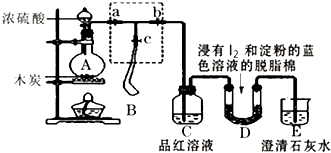
(1)装置A中盛放浓硫酸的仪器名称 .
(2)装置A中发生反应的化学方程式为 .
(3)实验时,装置C中的现象为 .
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写). ①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(5)当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2 , 而不是SO2;写出D中发生反应的化学方程式 , 当D中反应发生0.3mol电子转移时,发生反应的气体的体积(标准状况)是L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3 + 3ClO- + 4OH-=2RO4n- + 3Cl- + 5H2O,则RO4n-中R的化合价是
A.+6B.+5C.+4D.+3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下:
加氨水体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
(1)所测土壤的酸碱性如何?
(2)所用氨水的pH和c(OH﹣)分别为多少?
(3)为使该滤液呈中性,所加入氨水的恰当体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。已知部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:

(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
a.Na2O2 b.HNO3 c.FeCl3 d.KMnO4
(2)加入NaOH溶液调溶液pH=8时,除去的离子是________(填序号);已知钠离子交换树脂的原理:Mn++nNaRMRn+nNa+,此步操作被交换除去的杂质离子__________(填序号)。
a.Fe3+ b.Al3+ c.Ca2+ d.Mg2+
II.酸性条件下,铬元素主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。该法用Fe、石墨分别作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3和Fe(OH)3
(3)电解时连接铁棒的一极是电源的_________极。
(4)写出电解时阳极的电极反应式____________________;阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________;
(5)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至1×10-5molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com