
(16分)某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–: ,则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl,反应中的氧化产物是 (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3 (二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红稀溶液。
L-1KSCN溶液、品红稀溶液。
实验步骤 | 预期现象和结论 |
步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
步骤2:
| 结合步骤1的现象和结论,
|
(1)(4分)取少量样品溶液于试管中(1分),先滴入足量的稀盐酸(1分),再滴入氯化钡溶液(1分),如果有白色沉淀生成(1分) (2)(4分)2H2O(2分) H2SO4(2分)
(3)(8分) ①假设2:Fe2+、H2SO3(2分)②
实验步骤 | 预期现象和结论 |
|
|
步骤2:另取2~3mL样品溶液于试管中滴入1~2mL品红稀溶液(1分) | 若品红溶液红色褪色(1分),则假设2成立(1分);若品红溶液不褪色(1分),则假设3或假设1成立。(1分)[结合步骤1的现象和结论] |
[说明:(1)验证“假设2”不能使用KMnO4溶液,因它可以同时氧化Fe2+和H2SO3;
(2)由于用FeCl3溶液吸收制取SO2气体,Fe3+可以氧化H2SO3,故Fe3+与H2SO3不能共存,溶液中有H2SO3就一定有Fe2+。所以用品红验证了H2SO3的存在就不必再验证Fe2+。]
【解析】
试题分析:(1)Fe3+能够把H2SO3氧化成SO42-,溶液中存在硫酸根离子,证明反应发生了,硫酸根可以和钡离子反应生成白色沉淀,但是要排除碳酸根的干扰,所以硫酸根的检验方法是:取少量样品溶液于试管中,先滴入足量的稀盐酸,再滴入氯化钡溶液,如果有白色沉淀,就证明了Fe3+能够把H2SO3氧化成SO42-;
(2)二氧化硫可以被三价铁氧化为硫酸根离子,三价铁自身被还原为亚铁离子,所以产物有氯化亚铁和硫酸以及盐酸,根据电荷守恒和原子守恒,氯化铁和二氧化硫反应的化学方程式为:2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl,反应中化合价升高元素是S,所以硫酸是氧化产物;
(3)①三价铁离子具有氧化性,亚硫酸具有还原性,二者不能组合,所以假设2:溶液中存在Fe2+、H2SO3;
②三价铁能使硫氰酸钾显红色,亚硫酸中的二氧化硫能使品红褪色,检验三价铁可以将0.1mol/LKSN溶液1~2滴加到待测样品中,检验亚硫酸可以将品红滴到样品中,验证时不能使用KMnO4溶液,因它可以同时氧化Fe2+和H2SO3,由于用FeCl3溶液吸收制取SO2气体,Fe3+可以氧化H2SO3,故Fe3+与H2SO3不能共存,溶液中有H2SO3就一定有Fe2+,所以用品红验证了H2SO3的存在就不必再验证Fe2+。
考点:考查学生氧化还原反应的有关知识以及实验方案设计


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列因果关系成立的是
A.因为维生素C受热易被氧化,所以有些新鲜蔬菜生吃较好
B.因为SO2可以使溴水褪色,所以SO2具有漂白性
C.因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH
D.因为NH3的水溶液可以导电,所以NH3是电解质
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:填空题
有关物质间有下图所示的转化关系。已知B、D、G是常见的金属单质,E为常见非金属单质,H常温下为无色液体,K为红棕色气体。
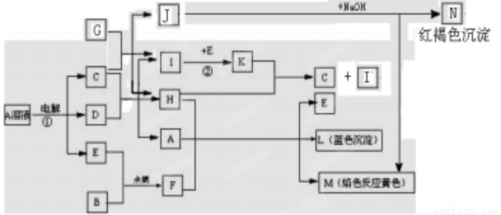
(1)F的电子式_____________,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目_____________________________________
(2)反应①的离子方程式_________________________________________.
(3)C与足量G反应的化学方程式_______________________________,其中,还原剂与氧化剂的物质的量之比______________________,检验反应中生成金属离子的方程式__________________________________
(4)Al能与A发生置换反应,生成物溶质与Na2CO3不能在溶液中共存,用离子方程式表示其原因:___________________________
(5)I可由某种氢化物催化氧化得到,其化学反应方程式为________________________
(6)漂白粉同F都应密封保存,写出漂白粉露置于空气中失效的化学反应方程式______________________、__________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列有关溶液的说法正确的是()
A.配置20g密度为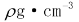 的Ca(NO3)2溶液中含有2gCa(NO3)2,则溶液中NO3-的物质的量浓度为25
的Ca(NO3)2溶液中含有2gCa(NO3)2,则溶液中NO3-的物质的量浓度为25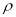 /41mol·L-1
/41mol·L-1
B.要配置浓度为0.25mol·L-1的NaOH溶液480mL,应称量4.8gNaOH在250mL的烧杯中溶解,冷却,再转移到500mL容量瓶中,洗涤、转移、定容
C.配置一定物质的量浓度的溶液定容时,俯视刻度线导致所配浓度偏高
D.配置NaOH溶液,在烧杯中溶解NaOH后未冷却至室温就转移到容量瓶中,溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
有关下列离子方程式的说法正确的是()
A.等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)↓+H2O
B.向NaAlO2溶液中通入过量CO2的反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
C.等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:填空题
(15)二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:选择题
分类思想是学习化学的重要思想,从分类的角度分析正确的是
A.SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物
B.Na2O和NH3的水溶液均能导电,故均为电解质
C.Si和SiO2均属于原子晶体
D.Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com