
【题目】下列电离方程式中,书写不正确的是( )
A.Ca(OH)2=Ca2++2OH-B.NaOH=Na++O2-+H+
C.HCl=H++Cl-D.KHCO3=K++HCO3-
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是( ) 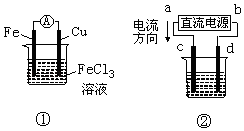
A.装置①是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+
B.装置①中,铁做负极,该电极反应式为:Fe3++e﹣═Fe2+
C.装置②为铁上镀铜装置c为纯铜电极
D.若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
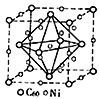
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化钴(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺流程如下:
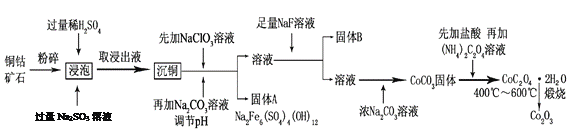
请回答下列问题:
(1)“浸泡”过程中,CoO(OH)可转化为CoSO4,请将该反应的化学方程式补充完整:
2CoO(OH)+2H2SO4+□_______=□CoSO4+□_______+□_______,_____________
(2)固体B的成分是______________________(填化学式)。
(3)向“沉铜”后的滤液中加入NaClO3溶液的主要目的是___________________;若上述流程中固、液分离均采用过滤操作,则共有________________处使用该操作。
(4)根据图1、图2分析:
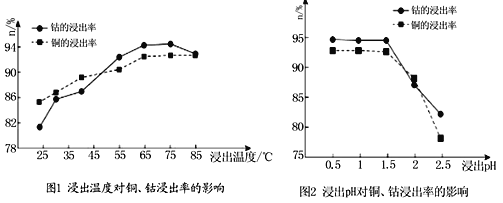
①矿石粉末浸泡的适宜条件应是________________________________。
②图2中铜、钴浸出率下降的可能原因是___________________________________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是_____________。
(6)LiCoO2可用于电动汽车的电池,其工作原理如右图所示,且电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为:LixC6+Li1-xCoO2 ![]() C6 +LiCoO2
C6 +LiCoO2
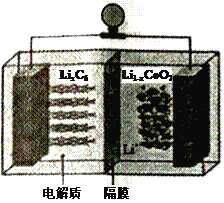
①放电时,Li+移动的方向为_________→___________。(填“ 左”或“ 右”)
②放电时正极的电极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池的工作原理如图所示。其中多孔电极材料选用纳米多孔金时, 该电池表现出良好的循环性能。电池反应为: 2Li+O2=Li2O2。 下列说法错误
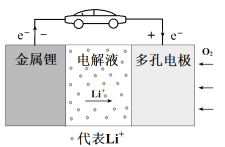
A. 该电池的电解液常用锂盐的有机溶液
B. 电池工作时,外电路中流过 0.01 mol 电子,负极材料减重 0.07g
C. 电池工作时,正极反应可能经过两个过程: Li++O2+e-=LiO2 Li++LiO2+e-=Li2O2
D. 电池充电时间越长,电池中 Li2O2越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组同学受葡萄糖与新制氢氧化铜悬浊液反应实验的启示,拟设计实验利用氧化铜探究乙醛的还原性。
【提出猜想】 猜想 1: CH3CHO+2CuO ![]() CH3COOH+Cu2O;
CH3COOH+Cu2O;
猜想 2:_______________________ (写出化学方程式)。
【定性实验】(1)甲同学设计下图装置进行实验(部分夹持装置已略去):

已知: 乙醛和乙酸的沸点分别为 20.8℃、 117.9℃。
按上述装置进行实验,当氧化铜完全反应后停止实验。
①为达到良好的冷凝效果,方框中 C 装置应选用_________(填仪器名称);实验中先通入乙醛蒸气,后点燃装置 B 处酒精灯,这样操作的目的是_________。
②已知: Cu2O 呈红色,在酸性条件下发生反应 Cu2O+2H+=Cu+Cu2++H2O。 请你设计实验证明猜想 1 成立。
实验操作:____________________________________ 。
实验现象:____________________________________ 。
【定量实验】(2)乙同学设计了如下图所示实验方案定量探究红色固体的成分。
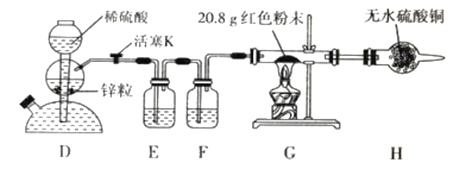
已知:醋酸亚铬[Cr(CH3COO)2]溶液可以吸收少量的 O2。
①下列有关说法正确的是(填标号)_______ 。
a. 装置 D 可以控制反应的发生与停止
b. 装置 F 中盛装醋酸亚铬溶液
c. 向装置 D 中加入少量硫酸铜固体可加快反应
d. 实验中观察到装置 G 中有明显现象
②装置 G 中红色粉末完全反应后,称得固体粉末质量为 19.2 g;装置 H 净增质量为2.0 g。请选择合理数据计算,确定红色粉末的成分及物质的量: _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化的主要反应原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。下列说法正确的是
2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。下列说法正确的是
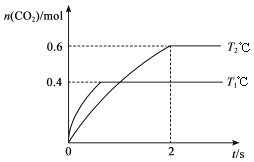
A. 该反应是吸热反应
B. T1℃时,K=0.9
C. T2℃时,0~2s内的平均反应速率v(N2)=0.075 mol/(L·s)
D. T1℃时,向平衡体系中加入1 mol NO,再次平衡时NO转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为 .
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池,其电池总反应为:V3++VO2++H2O ![]() VO2++2H++V2+ . 下列说法正确的是( )
VO2++2H++V2+ . 下列说法正确的是( )
A.放电时正极反应为:VO2++2H++e﹣=VO2++H2O
B.放电时每转移2mol电子时,消耗1mol氧化剂
C.充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极
D.放电过程中,H+由正极移向负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com