
 2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )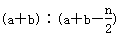
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源:不详 题型:填空题
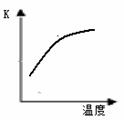
 4NH3 (g)+3O2 (g)+ Q
4NH3 (g)+3O2 (g)+ Q 
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3CH2OH(g)+3H2O(g) 。
CH3CH2OH(g)+3H2O(g) 。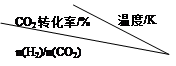 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
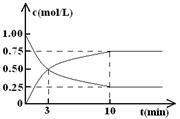
 C(气) (正反应为放热反应)达到平衡后,根据下列图象判断:
C(气) (正反应为放热反应)达到平衡后,根据下列图象判断:
| A. | B. | C. | D.E. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表: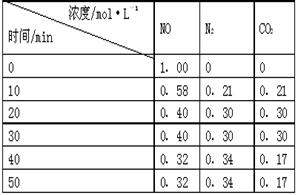
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了O.8 mol B,并测得C的浓度为O.4 mol/L,请填写下列空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
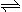 2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生成1mol乙酸乙酯的同时,也生成1mol乙酸 |
| B.乙酸、乙醇、乙酸乙酯的浓度相同 |
| C.当乙酸断开1mol碳氧单键的同时,乙醇也断开了1mol氢氧键 |
| D.当乙酸断开1mol氢氧键的同时,乙醇也断开了1mol碳氧单键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com